Home » Research
Research
Research projects
Prevention of Hereditary Breast Cancer through Personalized Optimization of Se, Zn, Fe Levels in the Body Using Dietary Supplements
Agreement No. INNOMED/I/16/NCBR/2014
Project Duration as per the Agreement: 01.10.2014-30.09.2019. The project co-financed by the European Union under the European Regional Development Fund
The project partner is the West Pomeranian University of Technology in Szczecin
Characteristics of the studied groups
The study groups, whose analyses form the basis for the results described below, were created from individuals registered in the Hereditary Cancer Center in Szczecin between 2009 and 2020. Each patient provided informed consent for the storage and use of biological material for scientific purposes. Blood and serum samples were collected between 8 AM and 2 PM, and patients fasted for at least 4 hours before collection. For the majority of patients, a sample was collected only once, but in some cases, multiple samples were taken during subsequent visits. Biological material was stored at -80°C until the element concentrations were determined. Each participant in the study completed a health and lifestyle questionnaire.
A total of 2962 healthy women were included in the prospective cohort. During 42 months of follow-up, 148 women were diagnosed with cancer.
The characteristics of the group are presented in the table.
| Cases (n=148) | Healthy (n=2814) | |
| Average age (range) | 56,46 (35-82) | 53 (33-84) |
Smoking current former never | 40 (27,03%) 34 (22,97%) 74 (50 %) | 605 (21,50%) 750 (26,65%) 1459 (51,84%) |
Hormone replacement therapy / oral contraceptives no yes missing data | 93 (62,84%) 54 (36,49%) 1 (0,67%) | 1467 (52,13%) 1316 (46,77%) 31 (1,1%) |
Adnexektomia no yes missing data | 135 (91,22%) 9 (6,08%) 4 (2,7%) | 2631 (93,50%) 175 (6,22%) 8 (0,28%) |
Cancers (location) breast uterus colon melanoma thyroid ovary cervix lymphoma bladder lung kidney stomach leukemia myeloma glioblastoma pancreas |
76 (51,4%) 12 (8,1%) 10 (6,8%) 7 (4,7%) 7 (7,73%) 6 (4,05%) 5 (3,38%) 5 (3,38%) 4 (2,7%) 4 (2,7%) 3 (2,03%) 3 (2,03%) 2 (1,35%) 2 (1,35%) 1 (0,68%) 1 (0,68%) |
– – – – – – – – – – – – – – – – |
| Cases (n=107) | Healthy (n=1217) | |
| Average age (range) | 44,25 (26-66) | 40,5 (25-69) |
| Smoking
current former never missing data |
24 (22,43%) 27 (25,23%) 55 (51,4%) 1 (0,93%) |
254 (20,87%) 249 (20,46%) 699 (57,44%) 15 (1,23%) |
| Hormone replacement therapy / oral contraceptives
no yes missing data |
46 (43%) 60 (56,07%) 1 (0,93%) |
603 (49,55%) 592 (48,64%) 22 (1,81%) |
| Adnexektomia
no yes missing data |
52 (48,6%) 55 (51,4%) 0 |
688 (56,53%) 510 (41,92%) 19 (1,56%) |
| Cancers (location)
breast ovary cervix peritoneum stomach colon leukemia pancreas skin larynx thyroid bladder |
80 (74,8%) 15 (14%) 3 (2,8%) 1 (0,9%) 1 (0,9%) 1 (0,9%) 1 (0,9%) 1 (0,9%) 1 (0,9%) 1 (0,9%) 1 (0,9%) 1 (0,9%) |
– – – – – – – – – – – – |
| Cases (n=144) | Healthy (n=2812) | |
| Average age (range) | 60,5 (36-76) | 52 (31-87) |
| Smoking
current former never |
42 (29,17%) 55 (38,19%) 47 (32,64 %) |
829 (29,48%) 975 (34,67%) 1008 (35,85%) |
| Cancers (location)
prostate skin kidney colon bladder blood lung liver thyroid pancreas stomach breast esophagus pituitary gland salivary glands testis |
58 (40,28%) 16 (11,11%) 13 (9,03%) 13 (9,03%) 12 (8,33%) 9 (6,25%) 6 (4,17%) 4 (2,78%) 4 (2,78%) 2 (1,39%) 2 (1,39%) 1 (0,69%) 1 (0,69%) 1 (0,69%) 1 (0,69%) 1 (0,69%) |
– – – – – – – – – – – – – – – – |
| Alive (n=417) | Deaths (n=121) | |
| Average age (range) | 55,87 (25-85) | 61,07 (28-91) |
| Smoking
current former never missing data |
89 (21,3%) 112 (26,9%) 206 (49,4%) 10 (2,4%) |
26 (21,5%) 27 (22,3%) 65 (53,7%) 3 (2,5%) |
| Estrogen receptor
positive (ER+) negative (ER-) missing data |
287 (68,8%) 114 (27,3%) 16 (3,8%) |
79 (65,3%) 32 (26,4%) 10 (8,26%) |
| BRCA1 mutation | 50 (12%) | 11 (9,1%) |
| Chemotherapy
yes no missing data |
211 (50,6%) 174 (41,7%) 32 (7,7%) |
65 (53,7%) 36 (29,8%) 20 (16,5%) |
| Radiotherapy
yes no missing data |
244 (58,5%) 122 (29,3%) 51 (12,2%) |
56 (46,3%) 35 (28,9%) 30 (24,8%) |
| Tamoxifen
yes no missing data |
282 (67,6%) 122 (29,3%) 13 (3,1%) |
79 (65,3%) 33 (27,3%) 9 (7,4%) |
| Type of operation
mastectomy lumpectomy missing data |
261 (62,6%) 131 (31,4%) 25 (6%) |
82 (67,8%) 17 (14%) 22 (18,2%) |
The study included 357 patients with diagnosed and histopathologically confirmed prostate cancer. Blood was collected between 2009 and 2015 at the time of diagnosis of prostate cancer before treatment. The average follow-up period for patients was 5 years.
| Gleason scale | Alive (n=293) | Deaths (n=102) |
6 7 8 9 10 missing data | 85 (29%) 164 (56%) 20 (6,8%) 17 (5,8%) 2 (0,7%) 5 (1,7%) | 39 (38,2%) 35 (34,3%) 9 (8,8%) 11 (10,8%) 7 (6,9%) 2 (1,96%) |
| Clinical stage 1-2 3 4 missing data | 7 (2,7%) 232 (79,2%) 51 (17,4%) 2 (0,7%) | 4 (3,9%) 45 (44,1%) 53 (52%) – |
| Radiotherapy yes no | 84 (28,7%) 209 (71,3%) | 24 (23,5%) 78 (76,5%) |
| Chemotherapy yes no | 3 (1%) 290 (99%) | 4 (3,9%) 98 (96,1%) |
| Hormonetherapy yes no | 59 (20,1%) 234 (79,9%) | 40 (39,2%) 62 (60,8%) |
| Prostatectomy yes no | 233 (79,5%) 60 (20,5%) | 33 (32,4%) 69 (67,6%) |
| Orchidectomy yes no | 8 (2,7%) 285 (97,3%) | 11 (10,8%) 91 (89,2%) |
| n=315 | % | |
| Average age of cancer diagnosis (range) | 61,1 (41-86) | |
| Sex
women men |
49 266 |
15,6 84,4 |
| Clinical stage
1 2 3 4 |
72 42 70 131 |
22,8 13,3 22,2 41,6 |
| Pack-years (average, range) | 37,11 (0-150) | |
| Treatment
radiotherapy chemotherapy |
142 32 |
45,1 10,1 |
| % | ||
| Sex
men women |
196 106 |
64,9 35,1 |
| Average age (range) | 64,2 (43-86) | – |
| Pack-years (range) | 33,2 (0-232,8) | – |
| Smoking
yes no |
283 19 |
93,7 6,3 |
| Clinical stage
1 2 3 4 |
129 75 79 19 |
42,7 24,8 26,2 6,3 |
| Radiotherapy
yes no |
78 224 |
25,8 74,2 |
| Chemotherapy
yes no |
105 197 |
34,8 65,2 |
| Histological type
Adenocarcinoma Squamous cell carcinoma Large cell cancer Large and Small Cell Mixed Carcinoma Small Cell Carcinoma Other |
136 124 21 5 3 13 |
45 41,1 7 1,7 1 4,3 |
| Osoby chore | |
| Year of birth (range) | 1930-1976 |
| Average age at the blood donation (range) | 63,4 (35-84) |
| Sex
men women |
59 41 |
| First-Degree Relatives
with pancreatic cancer with other cancer |
4 43 |
| Smoking
yes no |
27 73 |
| Pack-years (range) | 28,99 (2-50) |
| Alive (n=344) | Deaths (n=31) | |
| Average age (range) | 54,6 (21-90) | 64,3 (38-86) |
| Sex
women men |
218 (63%) 126 (37%) |
14 (45%) 17 (55%) |
| Clinical stage
2 3 4-5 |
70 (20%) 145 (42%) 129 (38%) |
1 (3,2%) 12 (39%) 18 (58%) |
Research results
W organizmie selen działa poprzez białka, do których jest wbudowany w postaci selenocysteiny. Jako składnik selenobiałek selen odgrywa rolę enzymatyczną, jak i strukturalną[1]. Do jednych z ważniejszych funkcji selenobiałek należy udział w produkcji hormonów tarczycy, pobudzanie układu immunologicznego, oraz ochrona przed stresem oksydacyjnym.[2]
Zarówno niedobór jak i nadmiar tego pierwiastka może mieć niekorzystny wpływ na organizm. Prowadzi to do m.in. do zaburzeń pracy serca, zwyrodnienia serca i wątroby, zwiększenia ryzyka choroby nadciśnieniowej, ograniczenia sprawności układu odpornościowego, zaburzenia funkcji tarczycy, zaburzenia mineralizacji kości i prawidłowego wykształcenia zębów oraz zwiększenia ryzyka chorób nowotworowych. [3–7]
Ocena ryzyka wystąpienia nowotworów złośliwych u kobiet bez wykrytej mutacji w genie BRCA1
Kobiety powyżej 60 roku życia, niepalące mają istotnie 4,5 krotnie obniżone ryzyko, jeśli mają stężenie we krwi zawierające się w przedziale 94-104 µg/l. Natomiast kobiety powyżej 60 roku życia, które palą obecnie bądź paliły w przeszłości mają istotnie 3,5 krotnie obniżone ryzyko zachorowania na raka, jeśli mają stężenie selenu we krwi > 110 µg/l.
Częstość występowania raków u kobiet niepalących, powyżej 60 roku życia (wybrane zakresy).
| Grupa | Zakres [µg/l] | Osoby chore | Osoby zdrowe | OR | 95%CI | p |
| I | 94-104 | 3 | 114 | Ref. | Ref. | Ref. |
| II | <94 | 11 | 93 | 4,5 | 1,2-16,6 | 0,02* |
*wynik istotny statystycznie (p <0,05) P.438038
Częstość występowania raków u kobiet palących, powyżej 60 roku życia (wybrane zakresy).
| Grupa | Zakres [µg/l] | Osoby chore | Osoby zdrowe | OR | 95%CI | p |
| I | >110 | 4 | 97 | Ref. | Ref. | Ref. |
| II | <110 | 25 | 171 | 3,5 | 1,2-10,5 | 0,02* |
*wynik istotny statystycznie (p <0,05) P.438038
Ocena ryzyka wystąpienia nowotworów złośliwych u kobiet z wykrytą mutacją w genie BRCA1
Kobiety, poniżej 50 roku życia, ze stężeniem selenu we krwi zawierającym się w przedziale 70-80 µg/l, mają tendencję do blisko 5 krotnie obniżonego ryzyka raka w porównaniu do kobiet ze stężeniami selenu poza przedstawionym przedziałem.
Częstość występowania raków w zależności od stężenia selenu we krwi wśród kobiet poniżej 50 roku życia (wybrane zakresy).
| Grupa | Zakres [µg/l] | Osoby chore | Osoby zdrowe | OR | 95%CI | p |
| I | 70-80 | 1 | 56 | Ref. | Ref. | Ref. |
| II | <70 & >80 | 75 | 904 | 4,6 | 0,6-34,1 | 0,1* |
*wynik nieistotny statystycznie (p >0,05) P.435603
Kobiety, powyżej 50 roku życia, ze stężeniem selenu we krwi zawierającym się w przedziale 95-120 µg/l wykazują ponad 2 krotnie obniżone ryzyko zachorowania na raka w porównaniu do kobiet ze stężeniami selenu poza przedstawionym przedziałem.
Częstość występowania raków w zależności od stężenia selenu we krwi wśród kobiet powyżej 50 roku życia (wybrane zakresy).
| Grupa | Zakres [µg/l] | Osoby chore | Osoby zdrowe | OR | 95%CI | p |
| I | 95-120 | 13 | 156 | Ref. | Ref. | Ref. |
| II | <95 & >120 | 20 | 102 | 2,3 | 1,1-4,9 | 0,03* |
*wynik istotny statystycznie (p <0,05) P.435603
Ocena ryzyka wystąpienia nowotworów złośliwych u mężczyzn
Mężczyźni niepalący papierosów, ze stężeniem selenu we krwi zawierającym się w przedziale 100-110 µg/l wykazują blisko 4 krotnie obniżone ryzyko zachorowania na raka w porównaniu do mężczyzn ze stężeniami selenu poza tym przedziałem.
Częstość występowania raków w zależności od stężenia selenu we krwi wśród mężczyzn niepalących (wybrane zakresy).
| Grupa | Zakres [µg/l] | Osoby chore | Osoby zdrowe | OR | 95%CI | p |
| I | 100-110 | 5 | 260 | Ref. | Ref. | Ref. |
| II | <95 | 20 | 291 | 3,6 | 1,3-9,7 | 0,008* |
*wynik istotny statystycznie (p <0,05) P.437898 Natomiast mężczyźni powyżej 60 roku życia oraz palący papierosy w przeszłości bądź obecnie wykazują blisko 11 krotnie zmniejszone ryzyko zachorowania na nowotwór złośliwy, w przypadku występowania stężenia selenu we krwi >115 µg/l, w porównaniu do mężczyzn ze stężeniem selenu we krwi <115 µg/l.
Częstość występowania raków w zależności od stężenia selenu we krwi wśród mężczyzn palących powyżej 60 roku życia (wybrane zakresy).
| Grupa | Zakres [µg/l] | Osoby chore | Osoby zdrowe | OR | 95%CI | p |
| I | <115 | 1 | 83 | Ref. | Ref. | Ref. |
| II | ≥115 | 56 | 427 | 10,9 | 1,5-79,8 | 0,0013* |
*wynik istotny statystycznie (p <0,05) P.437898
Poniżej przedstawiono krzywą Kaplana-Meier’a dla powyższej korelacji.
Probability of cancer-free – prawdopodobieństwo niezachorowania na raka
Months after testing – czas obserwacji w miesiącach
Survival of patients with breast cancer
Kobiety z rakiem piersi mają istotnie większą szansę na 10-letnie przeżycie, jeśli ich stężenie selenu w surowicy wynosi >94,7 µg/l. Kobiety ze stężeniem selenu w surowicy < 70 µg/l mają ponad 25-krotnie zwiększone ryzyko zgonu w porównaniu z podgrupą o stężeniu selenu w surowicy 95-102,5 µg/l.
Częstość zgonów w zależności od stężenia selenu w surowicy u kobiet z rakiem piersi w ciągu 10 lat od rozpoznania (ćwiartki).
| Ćwiartki | Zakres [µg/l] | Żyjący | Zgony | HR | 95%CI | p |
| I | 52,1-76,7 | 89 | 46 | 2,35 | 1,12-4,55 | 0,01* |
| II | 76,8-85,1 | 105 | 29 | 1,52 | 0,76-3,02 | 0,23 |
| III | 85,2-94,6 | 105 | 29 | 1,95 | 1,01-3,76 | 0,047* |
| IV | 94,7-171,5 | 118 | 17 | Ref. | Ref. | Ref. |
*wynik istotny statystycznie (p <0,05)
Częstość zgonów w zależności od stężenia selenu w surowicy u kobiet z rakiem piersi w ciągu 10 lat od rozpoznania (zakresy).
| Ćwiartki | Zakres [µg/l] | Żyjący | Zgony | OR | 95%CI | p |
| I | < 70 | 32 | 28 | Ref. | Ref. | Ref. |
| II | 95-102,5 | 62 | 2 | 27,1 | 6,7-121,2 | <0,0001* |
*wynik istotny statystycznie (p <0,05)
Powyższe wyniki stanowią część publikacji Szwiec M et al., Serum Selenium Level Predicts 10-Years Survival after Breast Cancer; Nutrients 2021, 13(3), 953. [8]
Survival of patients with prostate cancer
Mężczyźni z rakiem prostaty oraz stężeniem selenu w surowicy w zakresie 85-105 µg/l wykazują istotnie ponad 8 krotnie zmniejszone ryzyko zgonu w stosunku do podgrupy ze stężeniem selenu w surowicy poniżej 70 µg/l.
Częstość zgonów w zależności od stężenia selenu w surowicy u mężczyzn z rakiem prostaty w ciągu 5 lat od rozpoznania (wybrane zakresy).
| Grupa | Zakres [µg/l] | Żyjący | Zgony | OR | 95%CI | p |
| I | ≤70 | 61 | 33 | 8,6 | 3,4-21,7 | <0,0001* |
| II | 85-105 | 95 | 6 | Ref. | Ref. | Ref. |
*wynik istotny statystycznie (p <0,05) P.437046
Survival of patients with lung cancer
Zaobserwowano, że większe szanse na dłuższe przeżycie po diagnozie raka płuca maja osoby, u których stężenie selenu w surowicy wynosi >67,4 µg/l w porównaniu do osób o niskim stężeniu tego pierwiastka w surowicy (<55,1 µg/l).
Częstość zgonów w zależności od stężenia selenu w surowicy u pacjentów z rakiem płuca w I stopniu zaawansowania w ciągu 3 lat od rozpoznania (tertyle).
| Tertyle | Zakres [µg/l] | Ilość osób | OR | 95%CI | p |
| I | 33,46-57,91 | 43 | 2,73 | 1,21-6,11 | 0,01* |
| II | 57,92-68,86 | 42 | 1,88 | 0,83-4,28 | 0,13 |
| III | 69,29-108,27 | 44 | Ref. | Ref. | Ref. |
*wynik istotny statystycznie (p <0,05)
Powyższe wyniki stanowią część publikacji Pietrzak S. et al., Influence of the selenium level on overall survival in lung cancer, Journal of Trace Elements in Medicine and Biology 2019, 56:46-51.[9]
Survival of patients with pancreatic cancer
Pacjenci ze zdiagnozowanym rakiem trzustki mają 3-krotnie większą szansę na 6-miesięczne przeżycie, jeśli ich stężenie selenu w surowicy jest ≥ 63,67 µg/l w porównaniu do pacjentów ze stężeniem selenu poniżej tej wartości.
Częstość zgonów w zależności od stężenia selenu w surowicy u pacjentów z rakiem trzustki w ciągu 6 miesięcy od rozpoznania (wybrane zakresy).
| Grupa | Zakres [µg/l] | Żyjący | Zgony | OR | 95%CI | p |
| I | >< 63,67 | 24 | 33 | 0,4 | 0,1-0,97 | 0,03* |
| II | ≥ 63,67 | 22 | 11 | Ref. | Ref. | Ref. |
Powyższe wyniki stanowią część publikacji Lener M. et al., Serum concentration of Selenium and Copper in Patients Diagnosed with Pancreatic Cancer, Cancer Res Treat., 2016, 48(3):1056-1064.[10]
Survival of patients with melanoma
Pacjenci ze zdiagnozowanym czerniakiem złośliwym mają istotnie większą szansę na 10-lecie przeżycie, jeśli ich stężenie selenu w surowicy jest wyższe niż 96 µg/l. Pacjenci ze stężeniem selenu w surowicy < 76 µg/l mają blisko 6-krotnie zwiększone ryzyko zgonu w porównaniu z podgrupą o stężeniu selenu w surowicy > 96 µg/l.
Częstość zgonów w zależności od stężenia selenu w surowicy u pacjentów z czerniakiem złośliwym w ciągu 10 lat od rozpoznania (ćwiartki).
| Ćwiartki | Zakres [µg/l] | Żyjący | Zgony | HR | 95%CI | p |
| I | 56,7-76,2 | 78 | 16 | 5,83 | 1,32-25,8 | 0,02* |
| II | 76,4-85,01 | 86 | 7 | 3,37 | 0,7-16,3 | 0,13 |
| III | 85,15-96,06 | 88 | 6 | 3,34 | 0,67-16,7 | 0,14 |
| IV | 96,15-168 | 92 | 2 | Ref. | Ref. | Ref. |
*wynik istotny statystycznie (p<0,05) P.438563
Powyższe wyniki stanowią przedmiot publikacji Rogoża-Janiszewska E. et al., Serum selenium level and the 10-year survival after melanoma, Biomedicines, 2021.[11]
Arsen i jego związki są jednymi z najbardziej rozpoznawalnych trucizn. Według klasyfikacji międzynarodowej agencji do badań nad rakiem (IARC, ang. International Agency for Cancer Research) arsen i jego związki zostały określone jako bezwzględne ludzkie karcynogeny – grupa 1.[12] Różnorodność objawów klinicznych wywołanych inhalacją związkami arsenu lub jego spożyciem jest bardzo duża. W zależności od stężenia, czasu ekspozycji i drogi zaabsorbowania skutki oddziaływania arsenu z tkankami są od stosunkowo niegroźnych na przykład hipopigmentacji, po zagrażające życiu nowotwory (WHO). W świetle istniejących danych literaturowych można stwierdzić, że nie tylko wysokie, ale i nieznacznie podwyższone stężenia arsenu mogą być przyczyną raków, zwłaszcza u kobiet.
Evaluation of the cancer risk in women - BRCA1 non-carriers
Kobiety ze stężeniem arsenu we krwi poniżej 0,6 µg/l wykazują istotne blisko 5-krotnie obniżone ryzyko rozwoju raków zwłaszcza raków piersi w porównaniu do kobiet ze stężeniem arsenu powyżej 0,6 µg/l (OR=4,7; p=0,0004; 95%CI:1,9-11,7).
Częstość występowania raków piersi w zależności od stężenia arsenu we krwi (wybrane zakresy)
| Grupa | Zakres stężeń µg/l | Osoby chore | Osoby zdrowe | OR | 95%CI | p |
| I | <0,6 | 5 | 735 | Ref. | Ref. | Ref. |
| II | 0,6-0,81 | 18 | 723 | 3,7 | 1,4-10 | 0,01* |
| III | 0,82-1,25 | 21 | 719 | 4,3 | 1,6-11-5 | 0,002* |
| IV | >1,25 | 32 | 709 | 6,6 | 2,6-17,1 | <0,0001* |
| Wybrane zakresy | ||||||
| I | <0,6 | 5 | 735 | Ref. | Ref. | Ref. |
| II | ≥0,6 | 71 | 2222 | 4,7 | 1,9-11,7 | 0,0004* |
*wynik istotny statystycznie (p <0,05) P.425602
Poniżej przedstawiono krzywą dla powyższej korelacji.
Probability of cancer-free – prawdopodobieństwo niezachorowania na raka/ Months after testing – czas obserwacji w miesiącach
Powyższe wyniki stanowią przedmiot publikacji Marciniak W. et al., Blood arsenic levels and the risk of familial breast cancer in Poland, Int J Cancer, 2020, 146 (10): 2721-2727.[13]
Evaluation of the cancer risk in women - BRCA1 carriers
Kobiety ze stężeniem arsenu we krwi poniżej 0,85 µg/l wykazują istotnie około 2-krotnie obniżone ryzyko rozwoju raka w porównaniu do kobiet ze stężeniem arsenu powyżej 0,85 µg/l (OR=2.55; p=0,0006; 95%CI:1,47-4,43).
Częstość występowania nowotworów w zależności od stężenia arsenu we krwi.
| Grupa | Zakres stężeń µg/l | Osoby chore | Osoby zdrowe | OR | 95%CI | p |
| I | <0,85 | 18 | 513 | Ref. | Ref. | Ref. |
| II | >0,85 | 49 | 548 | 2,55 | 1,47-4,43 | 0,0006* |
*wynik istotny statystycznie (p <0,05)
Powyższe wyniki stanowią część publikacji Marciniak W. et al., Blood Arsenic Levels as a Marker of Breast Cancer Risk among BRCA1 Carriers, Cancers 2021, 13(13), 3345. [14]
Evaluation of the cancer risk in men
Wśród mężczyzn, u których stężenie arsenu we krwi wynosi pomiędzy 0,7 a 1,14 µg/l wykazano blisko 5-krotnie obniżone ryzyko zachorowania na raka.
Częstość występowania raków u mężczyzn w zależności od stężenia arsenu we krwi (wybrane zakresy)
| Grupa | Zakres [µg/l] | >Osoby chore | Osoby zdrowe | OR | 95%CI | p |
| I | 0,7-1,14 | 28 | 788 | Ref. | Ref. | Ref. |
| II | <0,7 & > 1,14 | 116 | 2003 | 4,8 | 1,1-2,5 | 0,03* |
*wynik istotny statystycznie (p <0,05) P.437896
Survival of patients with prostate cancer
Mężczyźni ze stężeniem arsenu w surowicy w zakresie 0,7-1,0 µg/l wykazują istotnie ponad 3-krotnie zmniejszone ryzyko zgonu w stosunku do podgrupy ze stężeniem arsenu w surowicy < 0,7 µg/l.
Częstość zgonów w zależności od stężenia arsenu w surowicy u mężczyzn z rakiem prostaty w ciągu 5 lat od rozpoznania (wybrane zakresy).
| Grupa | Zakres [µg/l] | Zgony | Żyjący | OR | 95%CI | p |
| I | <0,7 | 22 | 50 | 3,18 | 1,63-6,22 | 0,0009* |
| II | 0,7-1,0 | 22 | 159 | Ref. | Ref. | Ref. |
| III | >1,0 | 21 | 83 | 1,83 | 0,95-3,52 | 0,085 |
*wynik istotny statystycznie (p <0,05) P.437046
Według IARC kadm i jego związki zostały określone jako bezwzględne ludzkie karcynogeny – grupa 1.[12] Niekorzystne działanie kadmu i jego związków może prowadzić do chorób nerek, sercowo-naczyniowych, nadciśnienia, anemii, uszkodzeń wątroby, zaburzeń funkcjonowania narządów płciowych, zaburzeń układu immunologicznego, niedoborów żelaza, miedzi i cynku, a także rozwinięcia choroby nowotworowej.[15] Liczne prace opisują zwiększone stężenia kadmu w materiale biologicznym osób, które zachorowały na raki prostaty[16,17], nerki[18], pęcherza moczowego[19,20], trzustki[21,22] i piersi[23,24].
W literaturze wymienia się trzy główne źródła kadmu: dieta, palenie tytoniu oraz ekspozycja zawodowa[25]. Stężenie kadmu w produktach spożywczych jest silnie zależne od zawartości tego pierwiastka w środowisku – powietrzu, glebie oraz wodzie[25]. Stężenie kadmu we krwi jest mocno skorelowane z paleniem wyrobów tytotniowych. U osób niepalących stężenie Cd jest niższe w porównaniu do palaczy[26]. Grupę zawodową bardziej narażoną na działanie kadmu stanowią pracownicy przemysłu cynkowego, stalowego i miedziowego oraz przy produkcji baterii niklowo-kadmowych, ogniw słonecznych i biżuterii[27].
Evaluation of the cancer risk in women - BRCA1 non-carriers
Poniższa tabela przedstawia rozkład osób badanych w wybranym przez nas zakresie. Ryzyko zachorowania na raka jest ponad 8-krotnie zmniejszone wśród kobiet, których stężenie znajduje się w zakresie 0,28-0,33 µg/l.
Częstość występowania raków w zależności od stężenia kadmu we krwi u kobiet nie palących powyżej 50 roku życia (wybrany zakres)
| Grupa | Zakres [µg/l] | Osoby chore | Osoby zdrowe | OR | 95%CI | p |
| I | 0,28-0,33 | 1 | 126 | Ref. | Ref. | Ref. |
| II | <0,28 & >0,33 | 44 | 665 | 8,34 | 1,1-61,1 | 0,009* |
*wynik istotny statystycznie (p <0,05) P.437608
Ocena ryzyka wystąpienia nowotworów złośliwych u kobiet z wykrytą mutacją w genie BRCA1
U kobiet poniżej 51 roku życia ze stężeniem kadmu we krwi ≤0,32 µg/l ryzyko zmniejszone jest ponad 8-krotnie w porównaniu do kobiet z wyższym poziomem kadmu.
Częstość występowania raków w zależności od stężenia kadmu we krwi u kobiet poniżej 51 roku życia (wybrany zakres)
| Grupa | Zakres [µg/l] | Osoby chore | Osoby zdrowe | OR | 95%CI | p |
| I | ≤0,32 | 1 | 92 | Ref. | Ref. | Ref. |
| II | >0,32 | 22 | 244 | 8,30 | 1,1-62,46 | 0,013* |
*wynik istotny statystycznie (p <0,05) PAT.237085
Powyższe wyniki stanowią przedmiot publikacji przesłanej do druku Derkacz R. et al., Blood Cadmium Level and the Risk of Cancer in Women with BRCA1 Mutations, Cancers, 2021.[28]
Evaluation of the cancer risk in men
Mężczyźni, którzy nigdy nie palili papierosów, u których stężenie kadmu we krwi wynosi < 0,14 µg/l mają blisko 6 krotnie obniżone ryzyko zachorowania na raka w stosunku do mężczyzn ze stężeniem kadmu we krwi > 0,28 µg/l.
Częstość występowania raków w zależności od stężenia kadmu we krwi u mężczyzn niepalących papierosów (ćwiartki)
| Ćwiartka | Zakres [µg/l] | Osoby chore | Osoby zdrowe | OR | 95%CI | p |
| I | 0,03-0,14 | 4 | 260 | Ref. | Ref. | Ref. |
| II | 0,14-0,21 | 7 | 257 | 1,77 | 0,51-6,12 | 0,54 |
| III | 0,21-0,28 | 15 | 249 | 3,92 | 1,28-11,96 | 0,02 |
| IV | 0,28-2,34 | 21 | 242 | 5,64 | 1,91-16,67 | 0,0004* |
*wynik istotny statystycznie (p <0,05)P.437897
Cynk jest pierwiastkiem niezbędnym dla prawidłowego funkcjonowania organizmu. Pełni funkcję ochronną przed wolnymi rodnikami, między innymi wchodząc w skład dysmutazy ponadtlenkowej (SOD2). Zaangażowany jest również w procesy immunologiczne, warunkuje prawidłową funkcję skóry czy też błon śluzowych. Bierze udział w magazynowaniu i wydzielaniu insuliny z trzustki, utrzymuje równowagę jonową innych mikroelementów, w tym selenu, magnezu czy miedzi, a także spełnia rolę detoksykacyjną w stosunku do metali ciężkich[29]. Niedobór tego pierwiastka prowadzi do poważnych zaburzeń takich jak: niedobory immunologiczne, zapalenia (m.in. SARS-Cov-2), nieprawidłowe gojenie ran, obniżenie płodności czy też problemy ze wzrokiem[29,30].
Zaobserwowano, że poziom cynku ulega zmianom w komórkach nowotworowych[31]. Prawidłowe komórki nabłonkowe prostaty akumulują cynk, zaś w komórkach rakowych poziom tego pierwiastka jest znacząco obniżony.[32] Uważa się, że cynk ma działanie przeciwnowotworowe hamując wzrost komórek nowotworowych i aktywując apoptozę. Znane są badania oceniające związek między stężeniem cynku a ryzykiem raków, ich wyniki są jednak rozbieżne. Niektóre z tych badań mówią, iż stężenie cynku w surowicy jest wyższe u osób z nowotworem [33–35], natomiast inne, że poziom ten jest niższy.[36] Wyniki przeprowadzonych do tej pory badań sugerują również, że odpowiednia ilość cynku w diecie działa chemoprewencyjnie. Osoby, których dieta jest bogata w cynk wykazują niższe ryzyko raka płuc niż osoby stosujące dietę ubogocynkową (OR 0,71; 95% CI 0,5-0,99). [37] Również ryzyko raka jelita grubego i odbytu jest niższe przy stosowaniu diety bogatocynkowej (RR 0,86; 95% CI 0,73-1,02).[38] Natomiast suplementacja cynkiem w bardzo wysokich dawkach powyżej 100 mg/dzień (zalecane dzienne spożycie cynku wynosi 8 mg/dzień dla kobiet a 12 mg/dzień dla mężczyzn) odnosi odwrotny efekt, znacząco zwiększając ryzyko wystąpienia raka prostaty (RR 2,29; 95% CI 1,06 – 4,95, p=0,03).[39] Poniżej przedstawiono wyniki badań przeprowadzonych w naszym Ośrodku.
Evaluation of the cancer risk in women - BRCA1 non-carriers
Kobiety niepalące, powyżej 50 roku życia ze stężeniem cynku we krwi w przedziale 5600-6100 µg/l mają 6,5 krotnie obniżone ryzyko zachorowania na raka w stosunku do kobiet ze stężeniem cynku poniżej 5600 µg/l, a 3,5 krotnie obniżone ryzyko w porównaniu do kobiet ze stężeniem cynku powyżej 6100 µg/l.
Częstość występowania raków w zależności od stężenia cynku we krwi u kobiet niepalących powyżej 50 roku życia
| Grupa | Zakres [µg/l] | Osoby chore | Osoby zdrowe | OR | 95%CI | p |
| I | <5600 | 20 | 198 | 6,5 | 1-89-22,12 | 0,0008* |
| II | 5600-6100 | 3 | 192 | Ref. | Ref. | Ref. |
| III | >6100 | 22 | 399 | 3,5 | 1,04-11,94 | 0,029 |
*wynik istotny statystycznie (p <0,05) P.437571
Evaluation of the cancer risk in women - BRCA1 carriers
Kobiety z mutacją w genie BRCA1, które nie paliły papierosów mają prawie 3 krotnie obniżone ryzyko zachorowania na raka, jeśli ich poziom cynku znajduje się w zakresie 6000-6700 µg/l. Takiej korelacji nie można stwierdzić wśród osób palących papierosy.
Częstość występowania raków w zależności od stężenia cynku we krwi u kobiet będących nosicielkami mutacji w genie BRCA1, które nie paliły papierosów (wybrane zakresy)
| Grupa | Zakres [µg/l] | Osoby chore | Osoby zdrowe | OR | 95%CI | p |
| I | 6000-6700 | 8 | 218 | Ref. | Ref. | Ref. |
| II | <6000&>6700 | 49 | 481 | 2,8 | 1,3-6,0 | 0,006* |
*wynik istotny statystycznie (p <0,05) P.425603
Evaluation of the cancer risk in men
Mężczyźni, którzy nie palili papierosów mają blisko 4 krotnie obniżone ryzyko zachorowania na raka, jeśli ich stężenie cynku we krwi zawiera się w przedziale 5600-6350 µg/l.
Częstość występowania raków w zależności od stężenia cynku we krwi u mężczyzn niepalących (wybrane zakresy)
| Ćwiartka | Zakres [µg/l] | Osoby chore | Osoby zdrowe | OR | 95%CI | p |
| I | 5600-6350 | 5 | 318 | Ref. | Ref. | Ref. |
| II | <5600&>6350 | 41 | 687 | 3,8 | 1,5-9,7 | 0,0018* |
*wynik istotny statystycznie (p <0,05) P.437894
Survival of patients with breast cancer
Kobiety ze zdiagnozowanym rakiem piersi oraz stężeniem cynku w surowicy > 1000 µg/l wykazują blisko 6-krotnie zmniejszone ryzyko zgonu w porównaniu do kobiet, u których to stężenie wynosi < 700 µg/l.
Tabela pokazuje częstość zgonów w zależności od stężenia cynku w surowicy u kobiet z rakiem piersi (n=538).
Częstość zgonów w zależności od stężenia cynku w surowicy u kobiet z rakiem piersi w ciągu 10 lat od rozpoznania (wybrane zakresy)
| Grupa | Zakres [µg/l] | Żyjący | Zgony | OR | 95%CI | p |
| I | ≤700 | 33 | 25 | 5,68 | 2,09-15,42 | 0,0003* |
| II | 700-850 | 181 | 54 | 2,24 | 0,91-5,53 | 0,088 |
| III | 851-1000 | 158 | 36 | 1,71 | 0,68-4,31 | 0,30 |
| IV | ≥1000 | 45 | 6 | Ref. | Ref. | Ref. |
*wynik istotny statystycznie (p <0,05) P.434767
Survival of patients with prostate cancer
Mężczyźni ze zdiagnozowanym rakiem prostaty, u których stężenie cynku w surowicy zawiera się w przedziale 1000-1200 µg/l wykazują prawie 4-krotnie zmniejszone ryzyko zgonu w stosunku do mężczyzn, u których stężenie to wynosi < 900 µg/l.
Częstość zgonów w zależności od stężenia cynku w surowicy u mężczyzn z rakiem prostaty w ciągu 5 lat od rozpoznania (ćwiartki)
| Grupa | Zakres [µg/l] | Żyjący | Zgony | OR | 95%CI | p |
| I | ≤760,38 | 56 | 34 | 8,4 | 3,31-21,33 | <0,0001* |
| II | 760,39-839,63 | 75 | 14 | 2,58 | 0,94-7,06 | 0,095 |
| III | 839,64-931,72 | 78 | 11 | 1,95 | 0,69-5,53 | 0,31 |
| IV | ≥931,73 | 83 | 6 | Ref. | Ref. | Ref. |
*wynik istotny statystycznie (p <0,05) P.437046
Wśród mężczyzn ze zdiagnozowanym rakiem prostaty, u których stężenie cynku w surowicy zawiera się w przedziale 1000-1200 zaobserwowano blisko 4-krotnie zmniejszone ryzyko zgonu, w stosunku do mężczyzn, u których stężenie cynku jest niższe niż 900 µg/l.
Częstość zgonów w zależności od stężenia cynku w surowicy u mężczyzn z rakiem prostaty ciągu 5 lat od rozpoznania (wybrane zakresy)
| Grupa | Zakres [µg/l] | Żyjący | Zgony | OR | 95%CI | p |
| I | <900 | 180 | 54 | 3,7 | 1,09-12,48 | 0,03* |
| II | 1000-1200 | 37 | 3 | Ref. | Ref. | Ref. |
*wynik istotny statystycznie (p <0,05) P.437046
Powyższe wyniki stanowią przedmiot zgłoszenia patentowego nr P.437046
Survival of patients with laryngeal cancer
Wśród osób z rakiem krtani ponad 2-krotnie zmniejszone ryzyko zgonu miały osoby chore ze stężeniem cynku powyżej 688 µg/l w surowicy w porównaniu do osób ze stężeniem <580 µg/l.
Częstość zgonów w zależności od stężenia cynku w surowicy u pacjentów z rakiem krtani w ciągu 5 lat od rozpoznania (tercyle)
| Grupa | Zakres µg/l] | Żyjący | Zgony | OR | 95%CI | p |
| I | 357,76-580,38 | 52 | 52 | 2,45 | 1,4-4,4 | <0,01* |
| II | 584,46-688,89 | 67 | 37 | 1,35 | 0,8-2,4 | 0,31 |
| III | 688,94-1317,87 | 76 | 31 | Ref. | Ref. | Ref. |
*wynik istotny statystycznie (p <0,05) P.427370
Powyższe wyniki stanowią przedmiot publikacji Lubiński J. et al., Survival of Laryngeal Cancer Patients Depending on Zinc Serum Level and Oxidative Stress Genotypes,Biomolecules2021, 11, 865.[40]
Miedź pełni różne funkcje w strukturze białek oraz jako katalizator dzięki zdolności do zmian stopnia utlenienia i redukcji i występuje w stanie utlenionym (Cu2+) lub zredukowanym (Cu+). Jony miedziowe mogą uczestniczyć w szerokim spektrum interakcji z białkami, umożliwiając powstawanie złożonych struktur oraz pośrednicząc w skomplikowanych reakcjach biochemicznych.[41,42] Miedź, podobnie jak inne pierwiastki śladowe, jest z jednej strony niezbędna dla organizmu, z drugiej jednak strony jest bardzo niebezpieczna. Generalnie jednak stany, które charakteryzują się ogólnym lub komórkowo-specyficznym nagromadzeniem miedzi zdarzają się rzadko i najczęściej występują w wyniku określonych zaburzeń o podłożu genetycznym.[43]
Evaluation of the cancer risk in women - BRCA1 non-carriers
Kobiety niepalące, w wieku poniżej 50 roku życia ze stężeniem miedzi we krwi pomiędzy 850-1000 µg/l mają niemal 3-krotnie zmniejszone ryzyko zachorowania na raka.
Częstość występowania raków u kobiet niepalących poniżej 50 roku życia, u których nie stwierdzono mutacji w genie BRCA1 (wybrane zakresy).
| Grupa | Zakres [µg/l] | Osoby chore | Osoby zdrowe | OR | 95%CI | p |
| I | 850-1000 | 16 | 493 | Ref. | Ref. | Ref. |
| II | <850 | 13 | 156 | 2,6 | 1,2-5,5 | 0,02* |
*wynik istotny statystycznie (p <0,05) P.438572
Zanieczyszczenie środowiska ołowiem stanowi nieustający problem dla rozwijających się społeczeństw. Toksyczne działanie ołowiu dotyczy głównie jego wpływu na układ krwiotwórczy[44], obwodowy i ośrodkowy układ nerwowy[45] oraz przewód pokarmowy[46]. Ze względu na wszechobecność ołowiu, praktycznie każdy człowiek narażony jest na kontakt z tym pierwiastkiem. Toksyczność ołowiu prowadzi między innymi do zmiany aktywności wielu enzymów oraz zaburzeń funkcji wolnych i strukturalnych białek w komórce[47]. Wiele badań sugeruje, że ważnym molekularnym mechanizmem toksyczności ołowiu jest jego udział w powstawaniu wolnych rodników tlenowych, które odgrywają dużą rolę w powstawaniu uszkodzeń wewnątrzkomórkowych oraz w patogenezie wielu schorzeń, w tym nowotworów złośliwych[48]. Według klasyfikacji karcynogenów IARC, ołów i jego związki należą do grupy 2a i 2b tj. potencjalnie karcinogennych[12].
Evaluation of the cancer risk in women - BRCA1 non-carriers
Kobiety, ze stężeniem ołowiu we krwi ≤ 8 µg/l, wykazują istotnie blisko 9-krotnie zmniejszone ryzyko rozwoju raka.
Częstość występowania nowotworów w zależności od stężenia ołowiu u kobiet. (wybrane zakresy).
| Grupa | Zakres [µg/l] | Osoby chore | Osoby zdrowe | OR | 95%CI | p |
| I | ≤8 | 1 | 372 | Ref. | Ref. | Ref. |
| II | >8 | 26 | 1094 | 8,84 | 1,2-65,41 | 0,006* |
*wynik istotny statystycznie (p <0,05) P.433150
Evaluation of the cancer risk in women - BRCA1 carriers
Kobiety, ze stężeniem ołowiu we krwi ≤ 8 µg/l, wykazują istotnie 3-krotnie zmniejszone ryzyko rozwoju raka.
Częstość występowania nowotworów w zależności od stężenia ołowiu u kobiet. (wybrane zakresy).
| Grupa | Zakres [µg/l] | Osoby chore | Osoby zdrowe | OR | 95%CI | p |
| I | ≤8 | 8 | 217 | Ref. | Ref. | Ref. |
| II | >8 | 87 | 812 | 2,9 | 1,4-6,1 | 0,002* |
*wynik istotny statystycznie (p <0,05) P.433150
Evaluation of the cancer risk in men
Mężczyźni poniżej 60 roku życia, niepalący wykazują blisko 8-krotnie obniżone ryzyko zachorowania, jeśli ich stężenie ołowiu jest niższe niż 13,5 µg/l.
Częstość występowania nowotworów w zależności od stężenia ołowiu u mężczyzn niepalących poniżej 60 roku życia (wybrane zakresy).
| Grupa | Zakres [µg/l] | Osoby chore | Osoby zdrowe | OR | 95%CI | p |
| I | <13,5 | 1 | 217 | Ref. | Ref. | Ref. |
| II | >13,5 | 16 | 447 | 7,8 | 1,02-59,0 | 0,017* |
*wynik istotny statystycznie (p <0,05) P.437899
Mężczyźni powyżej 60 roku życia, niepalący wykazują 4-krotnie obniżone ryzyko zachorowania na nowotwory, jeśli ich stężenie ołowiu zawiera się w przedziale 20-50 µg/l we krwi pełnej.
Częstość występowania nowotworów w zależności od stężenia ołowiu u mężczyzn niepalących powyżej 60 roku życia (wybrane zakresy).
| Grupa | Zakres [µg/l] | Osoby chore | Osoby zdrowe | OR | 95%CI | p |
| I | 20-50 | 3 | 74 | Ref. | Ref. | Ref. |
| II | <20 & >50 | 15 | 90 | 4,1 | 1,1-14,8 | 0,02* |
wynik istotny statystycznie (p <0,05) P.437899
Mangan (Mn) jest niezbędnym składnikiem odżywczym biorącym udział w prawidłowym funkcjonowaniu układu odpornościowego, regulacji poziomu cukru we krwi i energii komórkowej, rozmnażania, trawienia, wzrostu kości, krzepnięcia krwi i homeostazy oraz obrony przed reaktywnymi formami tlenu. Funkcje pełnione przez metaloproteiny manganu obejmują oksyreduktazy, transferazy, hydrolazy, liazy, izomerazy oraz ligazy. [49] Mn działa jako kofaktor dla różnych enzymów, w tym arginazy, syntetazy glutaminy (GS), karboksylazy pirogronianowej i dysmutazy ponadtlenkowej Mn (Mn-SOD) [50]. Mn ma tendencję do odkładania się w wątrobie, trzustce, kościach oraz mózgu [50].
W literaturze można znaleźć badania opisujące korelację pomiędzy stężeniem Mn w surowicy a ryzykiem raka piersi oraz jelita grubego. Opublikowane badania mają jednak charakter retrospektywny co powoduje, że nie są one wiarygodne dla stwierdzenia, że mangan jest markerem ryzyka zachorowania na raka. W naszym Ośrodku oceniliśmy korelację pomiędzy stężeniem manganu a przeżyciami kobiet z rakiem piersi.
Survival of patients with breast cancer
Kobiety ze zdiagnozowanym rakiem piersi, u których stężenie manganu w surowicy zawiera się w przedziale 1-10 µg/l, wykazują istotnie ponad 1,5 krotnie zmniejszone ryzyko zgonu w odniesieniu do pozostałych kobiet.
Częstość zgonów w zależności od stężenia manganu w surowicy u kobiet z rakiem piersi w ciągu 10 lat od rozpoznania (wybrane zakresy).
| Grupa | Zakres µg/l | Żyjący | Zgony | HR | 95%CI | p |
| I | 1,0-10,0 | 197 | 49 | Ref. | Ref. | Ref. |
| II | <1 & > 10 | 204 | 87 | 1,55 | 1,09-2,20 | 0,01* |
*wynik istotny statystycznie (p <0,05) P.438040
Chrom (Cr) należy do pierwiastków szeroko rozpowszechnionych w skorupie ziemskiej. Pierwiastek ten w niewielkich ilościach jest niezbędny dla prawidłowego funkcjonowania organizmu pełniąc rolę w przemianach metabolicznych glukozy, niektórych białek i tłuszczów [51–53]. Zwiększone dawki chromu mogą mieć silne działanie toksyczne, wpływając destrukcyjnie na wątrobę, nerki i układ krwiotwórczy oraz powodując nowotwory [51,54,55]. Stwierdzono, że Cr(VI) wykazuje silne działanie mutagenne. Wyniki badań asocjacyjnych wskazują na związek pomiędzy stężeniem chromu we krwi oraz ryzykiem nowotworów w obrębie głowy, szyi i jamy ustnej.
W naszym Ośrodku wykonano pracę nad korelacją pomiędzy stężeniem chromu w surowicy a przeżyciem kobiet ze zdiagnozowanym rakiem piersi.
Survival of patients with breast cancer
Kobiety ze zdiagnozowanym rakiem piersi, u których stężenie chromu w surowicy zawiera się w przedziale 0,20-3,5 µg/l, wykazują istotnie blisko 2 krotnie zmniejszone ryzyko zgonu.
Częstość zgonów w zależności od stężenia chromu w surowicy u kobiet z rakiem piersi w ciągu 10 lat od rozpoznania (wybrane zakresy).
| Grupa | Zakres µg/l | Żyjący | Zgony | HR | 95%CI | p |
| I | 0,20-3,5 | 202 | 54 | Ref. | Ref. | Ref. |
| II | <0,20 & > 3,5 | 199 | 82 | 1,8 | 1,28-2,54 | 0,0002* |
*wynik istotny statystycznie (p <0,05) P.438042
Kobiety palące papierosy, u których zdiagnozowano nowotwór złośliwy piersi, wykazują istotnie blisko 4,5 krotnie zmniejszone ryzyko zgonu, jeśli ich stężenie chromu w surowicy jest wyższe niż 0,5 µg/l.
Częstość zgonów w zależności od stężenia chromu w surowicy u kobiet palących z rakiem piersi w ciągu 10 lat od rozpoznania (wybrane zakresy).
| Grupa | Zakres µg/l | Żyjący | Zgony | HR | 95%CI | p |
| I | <0,5 | 157 | 56 | 4,46 | 1,39-14,26 | 0,01* |
| II | ≥0,5 | 38 | 3 | Ref. | Ref. | Ref. |
*wynik istotny statystycznie (p <0,05) P.438042
Norms
Pierwiastek | Grupa | Podgrupa | Norma [µg/l] | Publikacja/ Nr zgłoszenia patentowego |
Selenium | Kobiety BRCA1 (-) | Palenie (-); < 60 r.ż. Palenie (-); > 60 r.ż. Palenie (+) | 100-110 94-104 110-120 | P.438038 |
| Kobiety BRCA1 (+) | < 50 r.ż. > 50 r.ż. | 70-80 95-120 | P.435603 |
| men | Palenie (-) Palenie (+); < 60 r.ż. Palenie (+); > 60 r.ż. | 100-110 NZ* 115-130 | P.437898 |
Arsenic | Kobiety BRCA1 (-) | – | < 0,6 | Marciniak W., 2020[13] P.425602 |
| Kobiety BRCA1 (+) | – | < 0,85 | Marciniak W., 2021[14] |
| men | – | 0,7-1,14 | P.437896 |
Cadmium | Kobiety BRCA1 (-) | Palenie (-) < 50 r.ż. Palenie (-) > 50 r.ż. Palenie (+) | NZ* 0,28-0,33 NZ* | P.437608 |
| Kobiety BRCA1 (+) | Palenie (-) Palenie (+) | < 0,27 NZ* | Derkacz R, 2021[28] PAT.237085 |
| men | Palenie (-) Palenie (+) | < 0,21 NZ* | P.437897 |
Zinc | Kobiety BRCA1 (-) | Palenie (-); < 50 r.ż. Palenie (-); > 50 r.ż. Palenie (+) | NZ* 5600-6100 NZ* | P.437571 |
| Kobiety BRCA1 (+) | Palenie (-) Palenie (+) | 6000-6700 6400-6800 | P.425603 |
| men | Palenie (-) Palenie (+) | 5700-6350 NZ* | P.437894 |
Copper | Kobiety BRCA1 (-) | < 50 r.ż. > 50 r.ż. | 850-1000 < 1000 | P.438572 |
| Kobiety BRCA1 (+) | Palenie (-);< 50 r.ż. Palenie (-); > 50 r.ż. Palenie (+) | 750-825 < 1000 < 1000 | |
| men | – | < 800 | P.437895 |
Lead | Kobiety BRCA1 (-) | – | ≤ 7,5 | P.438655 |
| Kobiety BRCA1 (+) | – | < 8 | P.433150 |
| men | Palenie (-); < 60 r.ż. Palenie (-); > 60 r.ż. Palenie (+) | < 13,5 < 50 NZ* | P.437899 |
- NZ – dotychczas nie znaleziono korelacji pomiędzy stężeniem pierwiastka a ryzykiem raków w tej podgrupie klinicznej
- Kobiety BRCA1 (-) – kobiety bez wykrytej mutacji w genie BRCA1
- Kobiety BRCA1 (+) – kobiety z wykrytą mutacją w genie BRCA1
- Palenie (-) – osoby niepalące papierosów
- Palenie (+) – osoby palące papierosy
Pierwiastek | Grupa | Norma [µg/l] | Publikacja/ Nr zgłoszenia patentowego |
Selenium | women men | 95-102,5 | Lener M, 2016[10] Lubiński JA, 2018[56] Lubiński J, 20118[57] Pietrzak S, 2019[9] Szwiec M, 2021[8] Rogoża-Janiszewska E., 2021[11] P.437046 |
Arsenic | men | 0,75-1,0 | P.437046 |
Zinc | women men | 1025-1175 | Lubiński J, 2021[40] P.434767 P.437046 |
Copper | women men | <1000 ≤ 900 | P.436999 |
Chromium | women | >0,5 | P.438042 |
Manganese | women | 1-10 | P.438040 |
- Hariharan, S.; Dharmaraj, S. Selenium and Selenoproteins: It’s Role in Regulation of Inflammation. Inflammopharmacology 2020, 28, 667–695, doi:10.1007/s10787-020-00690-x.
- Combs, G.F.; Clark, L.C.; Turnbull, B.W. An Analysis of Cancer Prevention by Selenium. Biofactors 2001, 14, 153–159, doi:10.1002/biof.5520140120.
- Reddy, V.N.; Giblin, F.J.; Lin, L.R.; Dang, L.; Unakar, N.J.; Musch, D.C.; Boyle, D.L.; Takemoto, L.J.; Ho, Y.S.; Knoernschild, T.; et al. Glutathione Peroxidase-1 Deficiency Leads to Increased Nuclear Light Scattering, Membrane Damage, and Cataract Formation in Gene-Knockout Mice. Invest Ophthalmol Vis Sci 2001, 42, 3247–3255.
- Kuria, A.; Fang, X.; Li, M.; Han, H.; He, J.; Aaseth, J.O.; Cao, Y. Does Dietary Intake of Selenium Protect against Cancer? A Systematic Review and Meta-Analysis of Population-Based Prospective Studies. Crit Rev Food Sci Nutr 2020, 60, 684–694, doi:10.1080/10408398.2018.1548427.
- Jenkins, D.J.A.; Kitts, D.; Giovannucci, E.L.; Sahye-Pudaruth, S.; Paquette, M.; Blanco Mejia, S.; Patel, D.; Kavanagh, M.; Tsirakis, T.; Kendall, C.W.C.; et al. Selenium, Antioxidants, Cardiovascular Disease, and All-Cause Mortality: A Systematic Review and Meta-Analysis of Randomized Controlled Trials. Am J Clin Nutr 2020, 112, 1642–1652, doi:10.1093/ajcn/nqaa245.
- Schomburg, L. The Other View: The Trace Element Selenium as a Micronutrient in Thyroid Disease, Diabetes, and Beyond. Hormones (Athens) 2020, 19, 15–24, doi:10.1007/s42000-019-00150-4.
- Kenfield, S.A.; Van Blarigan, E.L.; DuPre, N.; Stampfer, M.J.; L Giovannucci, E.; Chan, J.M. Selenium Supplementation and Prostate Cancer Mortality. J Natl Cancer Inst 2015, 107, 360, doi:10.1093/jnci/dju360.
- Szwiec, M.; Marciniak, W.; Derkacz, R.; Huzarski, T.; Gronwald, J.; Cybulski, C.; Dębniak, T.; Jakubowska, A.; Lener, M.; Falco, M.; et al. Serum Selenium Level Predicts 10-Year Survival after Breast Cancer. Nutrients 2021, 13, 953, doi:10.3390/nu13030953.
- Pietrzak, S.; Wójcik, J.; Scott, R.J.; Kashyap, A.; Grodzki, T.; Baszuk, P.; Bielewicz, M.; Marciniak, W.; Wójcik, N.; Dębniak, T.; et al. Influence of the Selenium Level on Overall Survival in Lung Cancer. J Trace Elem Med Biol 2019, 56, 46–51, doi:10.1016/j.jtemb.2019.07.010.
- Lener, M.R.; Scott, R.J.; Wiechowska-Kozłowska, A.; Serrano-Fernández, P.; Baszuk, P.; Jaworska-Bieniek, K.; Sukiennicki, G.; Marciniak, W.; Muszyńska, M.; Kładny, J.; et al. Serum Concentrations of Selenium and Copper in Patients Diagnosed with Pancreatic Cancer. Cancer Res Treat 2016, 48, 1056–1064, doi:10.4143/crt.2015.282.
- Rogoża-Janiszewska E. et al Serum Selenium Level and the 10-Year Survival after Melanoma. Biomedicines SI: Role of Trace Elements in Chemoprevention and Cancer Therapy 2021.
- List of Classifications – IARC Monographs on the Identification of Carcinogenic Hazards to Humans Available online: https://monographs.iarc.who.int/list-of-classifications/ (accessed on 20 July 2021).
- Marciniak, W.; Derkacz, R.; Muszyńska, M.; Baszuk, P.; Gronwald, J.; Huzarski, T.; Cybulski, C.; Jakubowska, A.; Falco, M.; Dębniak, T.; et al. Blood Arsenic Levels and the Risk of Familial Breast Cancer in Poland. Int J Cancer 2020, 146, 2721–2727, doi:10.1002/ijc.32595.
- Marciniak, W.; Matoušek, T.; Domchek, S.; Paradiso, A.; Patruno, M.; Irmejs, A.; Roderte, I.; Derkacz, R.; Baszuk, P.; Kuświk, M.; et al. Blood Arsenic Levels as a Marker of Breast Cancer Risk among BRCA1 Carriers. Cancers 2021, 13, 3345, doi:10.3390/cancers13133345.
- Fowler, B.A. Monitoring of Human Populations for Early Markers of Cadmium Toxicity: A Review. Toxicol Appl Pharmacol 2009, 238, 294–300, doi:10.1016/j.taap.2009.05.004.
- Vinceti, M.; Venturelli, M.; Sighinolfi, C.; Trerotoli, P.; Bonvicini, F.; Ferrari, A.; Bianchi, G.; Serio, G.; Bergomi, M.; Vivoli, G. Case-Control Study of Toenail Cadmium and Prostate Cancer Risk in Italy. Sci Total Environ 2007, 373, 77–81, doi:10.1016/j.scitotenv.2006.11.005.
- Qayyum, M.A.; Shah, M.H. Comparative Study of Trace Elements in Blood, Scalp Hair and Nails of Prostate Cancer Patients in Relation to Healthy Donors. Biol Trace Elem Res 2014, 162, 46–57, doi:10.1007/s12011-014-0123-4.
- Pirincci, N.; Gecit, I.; Gunes, M.; Kaba, M.; Tanik, S.; Yuksel, M.B.; Arslan, H.; Demir, H. Levels of Serum Trace Elements in Renal Cell Carcinoma Cases. Asian Pac J Cancer Prev 2013, 14, 499–502, doi:10.7314/apjcp.2013.14.1.499.
- Kellen, E.; Zeegers, M.P.; Hond, E.D.; Buntinx, F. Blood Cadmium May Be Associated with Bladder Carcinogenesis: The Belgian Case-Control Study on Bladder Cancer. Cancer Detect Prev 2007, 31, 77–82, doi:10.1016/j.cdp.2006.12.001.
- Wolf, C.; Strenziok, R.; Kyriakopoulos, A. Elevated Metallothionein-Bound Cadmium Concentrations in Urine from Bladder Carcinoma Patients, Investigated by Size Exclusion Chromatography-Inductively Coupled Plasma Mass Spectrometry. Anal Chim Acta 2009, 631, 218–222, doi:10.1016/j.aca.2008.10.035.
- Farzin, L.; Moassesi, M.E.; Sajadi, F.; Ahmadi Faghih, M.A. Evaluation of Trace Elements in Pancreatic Cancer Patients in Iran. Middle East Journal of Cancer 2013, 4, 79–86.
- Amaral, A.F.S.; Porta, M.; Silverman, D.T.; Milne, R.L.; Kogevinas, M.; Rothman, N.; Cantor, K.P.; Jackson, B.P.; Pumarega, J.A.; López, T.; et al. Pancreatic Cancer Risk and Levels of Trace Elements. Gut 2012, 61, 1583–1588, doi:10.1136/gutjnl-2011-301086.
- Wu, H.-D.I.; Chou, S.-Y.; Chen, D.-R.; Kuo, H.-W. Differentiation of Serum Levels of Trace Elements in Normal and Malignant Breast Patients. Biol Trace Elem Res 2006, 113, 9–18, doi:10.1385/BTER:113:1:19.
- Deeb, M.; El-Sheredy, H.; Mohammed, A. The Role of Serum Trace Elements and Oxidative Stress in Egyptian Breast Cancer Patients. Advances in Breast Cancer Research 2016, 05, 37–47, doi:10.4236/abcr.2016.51004.
- Sabir, S.; Akash, M.S.H.; Fiayyaz, F.; Saleem, U.; Mehmood, M.H.; Rehman, K. Role of Cadmium and Arsenic as Endocrine Disruptors in the Metabolism of Carbohydrates: Inserting the Association into Perspectives. Biomed Pharmacother 2019, 114, 108802, doi:10.1016/j.biopha.2019.108802.
- Lee, J.-E.; Kim, H.-R.; Lee, M.; Kim, N.-H.; Wang, K.-M.; Lee, S.; Park, O.; Hong, E.-J.; Youn, J.-W.; Kim, Y.-Y. Smoking-Related DNA Methylation Is Differentially Associated with Cadmium Concentration in Blood. Biochem Genet 2020, 58, 617–630, doi:10.1007/s10528-020-09965-y.
- Bolam, T.; Bersuder, P.; Burden, R.; Shears, G.; Morris, S.; Warford, L.; Thomas, B.; Nelson, P. Cadmium Levels in Food Containing Crab Brown Meat: A Brief Survey from UK Retailers. Journal of Food Composition and Analysis 2016, 54, 63–69, doi:10.1016/j.jfca.2016.10.005.
- Derkacz R. et al. Blood Cadmium Level and the Risk of Cancer in Women with BRCA1 Mutations. Cancers, SI: Advances in Inherited Breast and Ovarian Cancer and Its Imaging 2021.
- Nasiadek, M.; Stragierowicz, J.; Klimczak, M.; Kilanowicz, A. The Role of Zinc in Selected Female Reproductive System Disorders. Nutrients 2020, 12, 2464, doi:10.3390/nu12082464.
- Puzanowska-Tarasiewicz, H.; Kuźmicka, L.; Tarasiewicz, M. Funkcje biologiczne wybranych pierwiastków i ich związków. 3, 3,. Polski Merkuriusz Lekarski : organ Polskiego Towarzystwa Lekarskiego. 2009, 419–422.
- To, P.K.; Do, M.H.; Cho, J.-H.; Jung, C. Growth Modulatory Role of Zinc in Prostate Cancer and Application to Cancer Therapeutics. Int J Mol Sci 2020, 21, E2991, doi:10.3390/ijms21082991.
- Zaichick VYe, null; Sviridova, T.V.; Zaichick, S.V. Zinc in the Human Prostate Gland: Normal, Hyperplastic and Cancerous. Int Urol Nephrol 1997, 29, 565–574, doi:10.1007/BF02552202.
- Siddiqui, M.K.J.; Jyoti, null; Singh, S.; Mehrotra, P.K.; Singh, K.; Sarangi, R. Comparison of Some Trace Elements Concentration in Blood, Tumor Free Breast and Tumor Tissues of Women with Benign and Malignant Breast Lesions: An Indian Study. Environ Int 2006, 32, 630–637, doi:10.1016/j.envint.2006.02.002.
- Pasha, Q.; Malik, S.A.; Shah, M.H. Statistical Analysis of Trace Metals in the Plasma of Cancer Patients versus Controls. J Hazard Mater 2008, 153, 1215–1221, doi:10.1016/j.jhazmat.2007.09.115.
- el-Ahmady, O.; el-Maraghy, A.; Ibrahim, A.; Ramzy, S. Serum Copper, Zinc, and Iron in Patients with Malignant and Benign Pulmonary Diseases. Nutrition 1995, 11, 498–501.
- Kuo, H.W.; Chen, S.F.; Wu, C.C.; Chen, D.R.; Lee, J.H. Serum and Tissue Trace Elements in Patients with Breast Cancer in Taiwan. Biol Trace Elem Res 2002, 89, 1–11, doi:10.1385/BTER:89:1:1.
- Zhou, W.; Park, S.; Liu, G.; Miller, D.P.; Wang, L.I.; Pothier, L.; Wain, J.C.; Lynch, T.J.; Giovannucci, E.; Christiani, D.C. Dietary Iron, Zinc, and Calcium and the Risk of Lung Cancer. Epidemiology 2005, 16, 772–779, doi:10.1097/01.ede.0000181311.11585.59.
- Zhang, X.; Giovannucci, E.L.; Smith-Warner, S.A.; Wu, K.; Fuchs, C.S.; Pollak, M.; Willett, W.C.; Ma, J. A Prospective Study of Intakes of Zinc and Heme Iron and Colorectal Cancer Risk in Men and Women. Cancer Causes Control 2011, 22, 1627–1637, doi:10.1007/s10552-011-9839-z.
- Leitzmann, M.F.; Stampfer, M.J.; Wu, K.; Colditz, G.A.; Willett, W.C.; Giovannucci, E.L. Zinc Supplement Use and Risk of Prostate Cancer. J Natl Cancer Inst 2003, 95, 1004–1007, doi:10.1093/jnci/95.13.1004.
- Lubiński, J.; Jaworowska, E.; Derkacz, R.; Marciniak, W.; Białkowska, K.; Baszuk, P.; Scott, R.J.; Lubiński, J.A. Survival of Laryngeal Cancer Patients Depending on Zinc Serum Level and Oxidative Stress Genotypes. Biomolecules 2021, 11, 865, doi:10.3390/biom11060865.
- Festa, R.A.; Thiele, D.J. Copper: An Essential Metal in Biology. Curr Biol 2011, 21, R877-883, doi:10.1016/j.cub.2011.09.040.
- Ceramella, J.; Mariconda, A.; Iacopetta, D.; Saturnino, C.; Barbarossa, A.; Caruso, A.; Rosano, C.; Sinicropi, M.S.; Longo, P. From Coins to Cancer Therapy: Gold, Silver and Copper Complexes Targeting Human Topoisomerases. Bioorg Med Chem Lett 2020, 30, 126905, doi:10.1016/j.bmcl.2019.126905.
- Linder, M.C. The Relationship of Copper to DNA Damage and Damage Prevention in Humans. Mutat Res 2012, 733, 83–91, doi:10.1016/j.mrfmmm.2012.03.010.
- Johnson, F.M. The Genetic Effects of Environmental Lead. Mutat Res 1998, 410, 123–140, doi:10.1016/s1383-5742(97)00032-x.
- Marchetti, C. Molecular Targets of Lead in Brain Neurotoxicity. Neurotox Res 2003, 5, 221–236, doi:10.1007/BF03033142.
- Tomczyk, J.; Lewczuk, E.; Abdrzejak, R. Ostre Zatrucia Organicznymi Związkammi Ołowiu.; Medycyna Pracy, 1999; Vol. 50;.
- Cellular Mechanisms of Lead Neurotoxicity – PubMed Available online: https://pubmed.ncbi.nlm.nih.gov/16501435/ (accessed on 20 July 2021).
- Nersesyan, A.; Kundi, M.; Waldherr, M.; Setayesh, T.; Mišík, M.; Wultsch, G.; Filipic, M.; Mazzaron Barcelos, G.R.; Knasmueller, S. Results of Micronucleus Assays with Individuals Who Are Occupationally and Environmentally Exposed to Mercury, Lead and Cadmium. Mutat Res 2016, 770, 119–139, doi:10.1016/j.mrrev.2016.04.002.
- Aschner, M.; Erikson, K. Manganese. Adv Nutr 2017, 8, 520–521, doi:10.3945/an.117.015305.
- Chen, P. Manganese Metabolism in Humans. Front Biosci 2018, 23, 1655–1679, doi:10.2741/4665.
- Bagchi, D.; Stohs, S.J.; Downs, B.W.; Bagchi, M.; Preuss, H.G. Cytotoxicity and Oxidative Mechanisms of Different Forms of Chromium. Toxicology 2002, 180, 5–22, doi:10.1016/s0300-483x(02)00378-5.
- Cefalu, W.T.; Hu, F.B. Role of Chromium in Human Health and in Diabetes. Diabetes Care 2004, 27, 2741–2751, doi:10.2337/diacare.27.11.2741.
- Vincent, J.B. The Biochemistry of Chromium. J Nutr 2000, 130, 715–718, doi:10.1093/jn/130.4.715.
- Anderson, R.A. Chromium Metabolism and Its Role in Disease Processes in Man. Clin Physiol Biochem 1986, 4, 31–41.
- Anderson, R.A. Chromium as an Essential Nutrient for Humans. Regul Toxicol Pharmacol 1997, 26, S35-41, doi:10.1006/rtph.1997.1136.
- Lubinski, J.; Marciniak, W.; Muszynska, M.; Huzarski, T.; Gronwald, J.; Cybulski, C.; Jakubowska, A.; Debniak, T.; Falco, M.; Kladny, J.; et al. Serum Selenium Levels Predict Survival after Breast Cancer. Breast Cancer Res Treat 2018, 167, 591–598, doi:10.1007/s10549-017-4525-9.
- Lubiński, J.; Marciniak, W.; Muszynska, M.; Jaworowska, E.; Sulikowski, M.; Jakubowska, A.; Kaczmarek, K.; Sukiennicki, G.; Falco, M.; Baszuk, P.; et al. Serum Selenium Levels and the Risk of Progression of Laryngeal Cancer. PLoS One 2018, 13, e0184873, doi:10.1371/journal.pone.0184873.
Home » Research
Research
Research projects
Prevention of Hereditary Breast Cancer through Personalized Optimization of Se, Zn, Fe Levels in the Body Using Dietary Supplements
Agreement No. INNOMED/I/16/NCBR/2014
Project Duration as per the Agreement: 01.10.2014-30.09.2019. The project co-financed by the European Union under the European Regional Development Fund
The project partner is the West Pomeranian University of Technology in Szczecin
Characteristics of the studied groups
The study groups, whose analyses form the basis for the results described below, were created from individuals registered in the Hereditary Cancer Center in Szczecin between 2009 and 2020. Each patient provided informed consent for the storage and use of biological material for scientific purposes. Blood and serum samples were collected between 8 AM and 2 PM, and patients fasted for at least 4 hours before collection. For the majority of patients, a sample was collected only once, but in some cases, multiple samples were taken during subsequent visits. Biological material was stored at -80°C until the element concentrations were determined. Each participant in the study completed a health and lifestyle questionnaire.
A total of 2962 healthy women were included in the prospective cohort. During 42 months of follow-up, 148 women were diagnosed with cancer.
The characteristics of the group are presented in the table.
| Cases (n=148) | Healthy (n=2814) | |
| Average age (range) | 56,46 (35-82) | 53 (33-84) |
Smoking current former never | 40 (27,03%) 34 (22,97%) 74 (50 %) | 605 (21,50%) 750 (26,65%) 1459 (51,84%) |
Hormone replacement therapy / oral contraceptives no yes missing data | 93 (62,84%) 54 (36,49%) 1 (0,67%) | 1467 (52,13%) 1316 (46,77%) 31 (1,1%) |
Adnexektomia no yes missing data | 135 (91,22%) 9 (6,08%) 4 (2,7%) | 2631 (93,50%) 175 (6,22%) 8 (0,28%) |
Cancers (location) breast uterus colon melanoma thyroid ovary cervix lymphoma bladder lung kidney stomach leukemia myeloma glioblastoma pancreas |
76 (51,4%) 12 (8,1%) 10 (6,8%) 7 (4,7%) 7 (7,73%) 6 (4,05%) 5 (3,38%) 5 (3,38%) 4 (2,7%) 4 (2,7%) 3 (2,03%) 3 (2,03%) 2 (1,35%) 2 (1,35%) 1 (0,68%) 1 (0,68%) | – – – – – – – – – – – – – – – – |
| Cases (n=107) | Healthy (n=1217) | |
| Average age (range) | 44,25 (26-66) | 40,5 (25-69) |
| Smoking
current former never missing data |
24 (22,43%) 27 (25,23%) 55 (51,4%) 1 (0,93%) |
254 (20,87%) 249 (20,46%) 699 (57,44%) 15 (1,23%) |
| Hormone replacement therapy / oral contraceptives
no yes missing data |
46 (43%) 60 (56,07%) 1 (0,93%) |
603 (49,55%) 592 (48,64%) 22 (1,81%) |
| Adnexektomia
no yes missing data |
52 (48,6%) 55 (51,4%) 0 |
688 (56,53%) 510 (41,92%) 19 (1,56%) |
| Cancers (location)
breast ovary cervix peritoneum stomach colon leukemia pancreas skin larynx thyroid bladder |
80 (74,8%) 15 (14%) 3 (2,8%) 1 (0,9%) 1 (0,9%) 1 (0,9%) 1 (0,9%) 1 (0,9%) 1 (0,9%) 1 (0,9%) 1 (0,9%) 1 (0,9%) |
– – – – – – – – – – – – |
| Cases (n=144) | Healthy (n=2812) | |
| Average age (range) | 60,5 (36-76) | 52 (31-87) |
| Smoking
current former never |
42 (29,17%) 55 (38,19%) 47 (32,64 %) |
829 (29,48%) 975 (34,67%) 1008 (35,85%) |
| Cancers (location)
prostate skin kidney colon bladder blood lung liver thyroid pancreas stomach breast esophagus pituitary gland salivary glands testis |
58 (40,28%) 16 (11,11%) 13 (9,03%) 13 (9,03%) 12 (8,33%) 9 (6,25%) 6 (4,17%) 4 (2,78%) 4 (2,78%) 2 (1,39%) 2 (1,39%) 1 (0,69%) 1 (0,69%) 1 (0,69%) 1 (0,69%) 1 (0,69%) |
– – – – – – – – – – – – – – – – |
| Alive (n=417) | Deaths (n=121) | |
| Average age (range) | 55,87 (25-85) | 61,07 (28-91) |
| Smoking
current former never missing data |
89 (21,3%) 112 (26,9%) 206 (49,4%) 10 (2,4%) |
26 (21,5%) 27 (22,3%) 65 (53,7%) 3 (2,5%) |
| Estrogen receptor
positive (ER+) negative (ER-) missing data |
287 (68,8%) 114 (27,3%) 16 (3,8%) |
79 (65,3%) 32 (26,4%) 10 (8,26%) |
| BRCA1 mutation | 50 (12%) | 11 (9,1%) |
| Chemotherapy
yes no missing data |
211 (50,6%) 174 (41,7%) 32 (7,7%) |
65 (53,7%) 36 (29,8%) 20 (16,5%) |
| Radiotherapy
yes no missing data |
244 (58,5%) 122 (29,3%) 51 (12,2%) |
56 (46,3%) 35 (28,9%) 30 (24,8%) |
| Tamoxifen
yes no missing data |
282 (67,6%) 122 (29,3%) 13 (3,1%) |
79 (65,3%) 33 (27,3%) 9 (7,4%) |
| Type of operation
mastectomy lumpectomy missing data |
261 (62,6%) 131 (31,4%) 25 (6%) |
82 (67,8%) 17 (14%) 22 (18,2%) |
The study included 357 patients with diagnosed and histopathologically confirmed prostate cancer. Blood was collected between 2009 and 2015 at the time of diagnosis of prostate cancer before treatment. The average follow-up period for patients was 5 years.
| Gleason scale | Alive (n=293) | Deaths (n=102) |
6 7 8 9 10 missing data | 85 (29%) 164 (56%) 20 (6,8%) 17 (5,8%) 2 (0,7%) 5 (1,7%) | 39 (38,2%) 35 (34,3%) 9 (8,8%) 11 (10,8%) 7 (6,9%) 2 (1,96%) |
| Clinical stage 1-2 3 4 missing data | 7 (2,7%) 232 (79,2%) 51 (17,4%) 2 (0,7%) | 4 (3,9%) 45 (44,1%) 53 (52%) – |
| Radiotherapy yes no | 84 (28,7%) 209 (71,3%) | 24 (23,5%) 78 (76,5%) |
| Chemotherapy yes no | 3 (1%) 290 (99%) | 4 (3,9%) 98 (96,1%) |
| Hormonetherapy yes no | 59 (20,1%) 234 (79,9%) | 40 (39,2%) 62 (60,8%) |
| Prostatectomy yes no | 233 (79,5%) 60 (20,5%) | 33 (32,4%) 69 (67,6%) |
| Orchidectomy yes no | 8 (2,7%) 285 (97,3%) | 11 (10,8%) 91 (89,2%) |
| n=315 | % | |
| Average age of cancer diagnosis (range) | 61,1 (41-86) | |
| Sex
women men |
49 266 |
15,6 84,4 |
| Clinical stage
1 2 3 4 |
72 42 70 131 |
22,8 13,3 22,2 41,6 |
| Pack-years (average, range) | 37,11 (0-150) | |
| Treatment
radiotherapy chemotherapy |
142 32 |
45,1 10,1 |
| % | ||
| Sex
men women |
196 106 |
64,9 35,1 |
| Average age (range) | 64,2 (43-86) | – |
| Pack-years (range) | 33,2 (0-232,8) | – |
| Smoking
yes no |
283 19 |
93,7 6,3 |
| Clinical stage
1 2 3 4 |
129 75 79 19 |
42,7 24,8 26,2 6,3 |
| Radiotherapy
yes no |
78 224 |
25,8 74,2 |
| Chemotherapy
yes no |
105 197 |
34,8 65,2 |
| Histological type
Adenocarcinoma Squamous cell carcinoma Large cell cancer Large and Small Cell Mixed Carcinoma Small Cell Carcinoma Other |
136 124 21 5 3 13 |
45 41,1 7 1,7 1 4,3 |
| Osoby chore | |
| Year of birth (range) | 1930-1976 |
| Average age at the blood donation (range) | 63,4 (35-84) |
| Sex
men women |
59 41 |
| First-Degree Relatives
with pancreatic cancer with other cancer |
4 43 |
| Smoking
yes no |
27 73 |
| Pack-years (range) | 28,99 (2-50) |
| Alive (n=344) | Deaths (n=31) | |
| Average age (range) | 54,6 (21-90) | 64,3 (38-86) |
| Sex
women men |
218 (63%) 126 (37%) |
14 (45%) 17 (55%) |
| Clinical stage
2 3 4-5 |
70 (20%) 145 (42%) 129 (38%) |
1 (3,2%) 12 (39%) 18 (58%) |
Research results
W organizmie selen działa poprzez białka, do których jest wbudowany w postaci selenocysteiny. Jako składnik selenobiałek selen odgrywa rolę enzymatyczną, jak i strukturalną[1]. Do jednych z ważniejszych funkcji selenobiałek należy udział w produkcji hormonów tarczycy, pobudzanie układu immunologicznego, oraz ochrona przed stresem oksydacyjnym.[2]
Zarówno niedobór jak i nadmiar tego pierwiastka może mieć niekorzystny wpływ na organizm. Prowadzi to do m.in. do zaburzeń pracy serca, zwyrodnienia serca i wątroby, zwiększenia ryzyka choroby nadciśnieniowej, ograniczenia sprawności układu odpornościowego, zaburzenia funkcji tarczycy, zaburzenia mineralizacji kości i prawidłowego wykształcenia zębów oraz zwiększenia ryzyka chorób nowotworowych. [3–7]
Ocena ryzyka wystąpienia nowotworów złośliwych u kobiet bez wykrytej mutacji w genie BRCA1
Kobiety powyżej 60 roku życia, niepalące mają istotnie 4,5 krotnie obniżone ryzyko, jeśli mają stężenie we krwi zawierające się w przedziale 94-104 µg/l. Natomiast kobiety powyżej 60 roku życia, które palą obecnie bądź paliły w przeszłości mają istotnie 3,5 krotnie obniżone ryzyko zachorowania na raka, jeśli mają stężenie selenu we krwi > 110 µg/l.
Częstość występowania raków u kobiet niepalących, powyżej 60 roku życia (wybrane zakresy).
| Grupa | Zakres [µg/l] | Osoby chore | Osoby zdrowe | OR | 95%CI | p |
| I | 94-104 | 3 | 114 | Ref. | Ref. | Ref. |
| II | <94 | 11 | 93 | 4,5 | 1,2-16,6 | 0,02* |
*wynik istotny statystycznie (p <0,05) P.438038
Częstość występowania raków u kobiet palących, powyżej 60 roku życia (wybrane zakresy).
| Grupa | Zakres [µg/l] | Osoby chore | Osoby zdrowe | OR | 95%CI | p |
| I | >110 | 4 | 97 | Ref. | Ref. | Ref. |
| II | <110 | 25 | 171 | 3,5 | 1,2-10,5 | 0,02* |
*wynik istotny statystycznie (p <0,05) P.438038
Ocena ryzyka wystąpienia nowotworów złośliwych u kobiet z wykrytą mutacją w genie BRCA1
Kobiety, poniżej 50 roku życia, ze stężeniem selenu we krwi zawierającym się w przedziale 70-80 µg/l, mają tendencję do blisko 5 krotnie obniżonego ryzyka raka w porównaniu do kobiet ze stężeniami selenu poza przedstawionym przedziałem.
Częstość występowania raków w zależności od stężenia selenu we krwi wśród kobiet poniżej 50 roku życia (wybrane zakresy).
| Grupa | Zakres [µg/l] | Osoby chore | Osoby zdrowe | OR | 95%CI | p |
| I | 70-80 | 1 | 56 | Ref. | Ref. | Ref. |
| II | <70 & >80 | 75 | 904 | 4,6 | 0,6-34,1 | 0,1* |
*wynik nieistotny statystycznie (p >0,05) P.435603
Kobiety, powyżej 50 roku życia, ze stężeniem selenu we krwi zawierającym się w przedziale 95-120 µg/l wykazują ponad 2 krotnie obniżone ryzyko zachorowania na raka w porównaniu do kobiet ze stężeniami selenu poza przedstawionym przedziałem.
Częstość występowania raków w zależności od stężenia selenu we krwi wśród kobiet powyżej 50 roku życia (wybrane zakresy).
| Grupa | Zakres [µg/l] | Osoby chore | Osoby zdrowe | OR | 95%CI | p |
| I | 95-120 | 13 | 156 | Ref. | Ref. | Ref. |
| II | <95 & >120 | 20 | 102 | 2,3 | 1,1-4,9 | 0,03* |
*wynik istotny statystycznie (p <0,05) P.435603
Ocena ryzyka wystąpienia nowotworów złośliwych u mężczyzn
Mężczyźni niepalący papierosów, ze stężeniem selenu we krwi zawierającym się w przedziale 100-110 µg/l wykazują blisko 4 krotnie obniżone ryzyko zachorowania na raka w porównaniu do mężczyzn ze stężeniami selenu poza tym przedziałem.
Częstość występowania raków w zależności od stężenia selenu we krwi wśród mężczyzn niepalących (wybrane zakresy).
| Grupa | Zakres [µg/l] | Osoby chore | Osoby zdrowe | OR | 95%CI | p |
| I | 100-110 | 5 | 260 | Ref. | Ref. | Ref. |
| II | <95 | 20 | 291 | 3,6 | 1,3-9,7 | 0,008* |
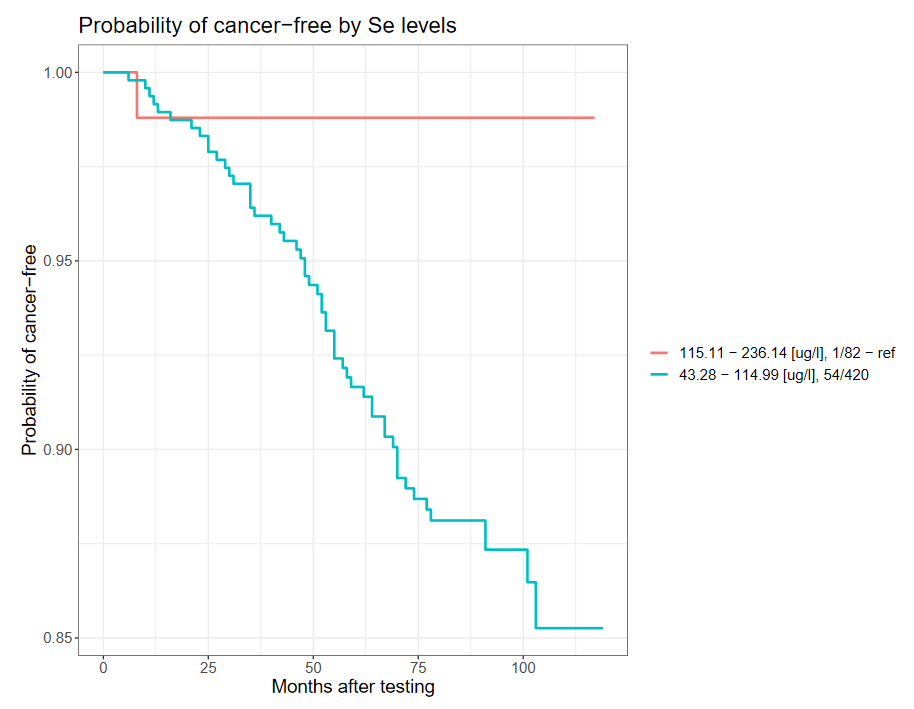
*wynik istotny statystycznie (p <0,05) P.437898 Natomiast mężczyźni powyżej 60 roku życia oraz palący papierosy w przeszłości bądź obecnie wykazują blisko 11 krotnie zmniejszone ryzyko zachorowania na nowotwór złośliwy, w przypadku występowania stężenia selenu we krwi >115 µg/l, w porównaniu do mężczyzn ze stężeniem selenu we krwi <115 µg/l.
Częstość występowania raków w zależności od stężenia selenu we krwi wśród mężczyzn palących powyżej 60 roku życia (wybrane zakresy).
| Grupa | Zakres [µg/l] | Osoby chore | Osoby zdrowe | OR | 95%CI | p |
| I | <115 | 1 | 83 | Ref. | Ref. | Ref. |
| II | ≥115 | 56 | 427 | 10,9 | 1,5-79,8 | 0,0013* |
*wynik istotny statystycznie (p <0,05) P.437898
Poniżej przedstawiono krzywą Kaplana-Meier’a dla powyższej korelacji.

Probability of cancer-free – prawdopodobieństwo niezachorowania na raka
Months after testing – czas obserwacji w miesiącach
Survival of patients with breast cancer
Kobiety z rakiem piersi mają istotnie większą szansę na 10-letnie przeżycie, jeśli ich stężenie selenu w surowicy wynosi >94,7 µg/l. Kobiety ze stężeniem selenu w surowicy < 70 µg/l mają ponad 25-krotnie zwiększone ryzyko zgonu w porównaniu z podgrupą o stężeniu selenu w surowicy 95-102,5 µg/l.
Częstość zgonów w zależności od stężenia selenu w surowicy u kobiet z rakiem piersi w ciągu 10 lat od rozpoznania (ćwiartki).
| Ćwiartki | Zakres [µg/l] | Żyjący | Zgony | HR | 95%CI | p |
| I | 52,1-76,7 | 89 | 46 | 2,35 | 1,12-4,55 | 0,01* |
| II | 76,8-85,1 | 105 | 29 | 1,52 | 0,76-3,02 | 0,23 |
| III | 85,2-94,6 | 105 | 29 | 1,95 | 1,01-3,76 | 0,047* |
| IV | 94,7-171,5 | 118 | 17 | Ref. | Ref. | Ref. |
*wynik istotny statystycznie (p <0,05)
Częstość zgonów w zależności od stężenia selenu w surowicy u kobiet z rakiem piersi w ciągu 10 lat od rozpoznania (zakresy).
| Ćwiartki | Zakres [µg/l] | Żyjący | Zgony | OR | 95%CI | p |
| I | < 70 | 32 | 28 | Ref. | Ref. | Ref. |
| II | 95-102,5 | 62 | 2 | 27,1 | 6,7-121,2 | <0,0001* |
*wynik istotny statystycznie (p <0,05)
Powyższe wyniki stanowią część publikacji Szwiec M et al., Serum Selenium Level Predicts 10-Years Survival after Breast Cancer; Nutrients 2021, 13(3), 953. [8]
Survival of patients with prostate cancer
Mężczyźni z rakiem prostaty oraz stężeniem selenu w surowicy w zakresie 85-105 µg/l wykazują istotnie ponad 8 krotnie zmniejszone ryzyko zgonu w stosunku do podgrupy ze stężeniem selenu w surowicy poniżej 70 µg/l.
Częstość zgonów w zależności od stężenia selenu w surowicy u mężczyzn z rakiem prostaty w ciągu 5 lat od rozpoznania (wybrane zakresy).
| Grupa | Zakres [µg/l] | Żyjący | Zgony | OR | 95%CI | p |
| I | ≤70 | 61 | 33 | 8,6 | 3,4-21,7 | <0,0001* |
| II | 85-105 | 95 | 6 | Ref. | Ref. | Ref. |
*wynik istotny statystycznie (p <0,05) P.437046
Survival of patients with lung cancer
Zaobserwowano, że większe szanse na dłuższe przeżycie po diagnozie raka płuca maja osoby, u których stężenie selenu w surowicy wynosi >67,4 µg/l w porównaniu do osób o niskim stężeniu tego pierwiastka w surowicy (<55,1 µg/l).
Częstość zgonów w zależności od stężenia selenu w surowicy u pacjentów z rakiem płuca w I stopniu zaawansowania w ciągu 3 lat od rozpoznania (tertyle).
| Tertyle | Zakres [µg/l] | Ilość osób | OR | 95%CI | p |
| I | 33,46-57,91 | 43 | 2,73 | 1,21-6,11 | 0,01* |
| II | 57,92-68,86 | 42 | 1,88 | 0,83-4,28 | 0,13 |
| III | 69,29-108,27 | 44 | Ref. | Ref. | Ref. |
*wynik istotny statystycznie (p <0,05)
Powyższe wyniki stanowią część publikacji Pietrzak S. et al., Influence of the selenium level on overall survival in lung cancer, Journal of Trace Elements in Medicine and Biology 2019, 56:46-51.[9]
Survival of patients with pancreatic cancer
Pacjenci ze zdiagnozowanym rakiem trzustki mają 3-krotnie większą szansę na 6-miesięczne przeżycie, jeśli ich stężenie selenu w surowicy jest ≥ 63,67 µg/l w porównaniu do pacjentów ze stężeniem selenu poniżej tej wartości.
Częstość zgonów w zależności od stężenia selenu w surowicy u pacjentów z rakiem trzustki w ciągu 6 miesięcy od rozpoznania (wybrane zakresy).
| Grupa | Zakres [µg/l] | Żyjący | Zgony | OR | 95%CI | p |
| I | >< 63,67 | 24 | 33 | 0,4 | 0,1-0,97 | 0,03* |
| II | ≥ 63,67 | 22 | 11 | Ref. | Ref. | Ref. |
Powyższe wyniki stanowią część publikacji Lener M. et al., Serum concentration of Selenium and Copper in Patients Diagnosed with Pancreatic Cancer, Cancer Res Treat., 2016, 48(3):1056-1064.[10]
Survival of patients with melanoma
Pacjenci ze zdiagnozowanym czerniakiem złośliwym mają istotnie większą szansę na 10-lecie przeżycie, jeśli ich stężenie selenu w surowicy jest wyższe niż 96 µg/l. Pacjenci ze stężeniem selenu w surowicy < 76 µg/l mają blisko 6-krotnie zwiększone ryzyko zgonu w porównaniu z podgrupą o stężeniu selenu w surowicy > 96 µg/l.
Częstość zgonów w zależności od stężenia selenu w surowicy u pacjentów z czerniakiem złośliwym w ciągu 10 lat od rozpoznania (ćwiartki).
| Ćwiartki | Zakres [µg/l] | Żyjący | Zgony | HR | 95%CI | p |
| I | 56,7-76,2 | 78 | 16 | 5,83 | 1,32-25,8 | 0,02* |
| II | 76,4-85,01 | 86 | 7 | 3,37 | 0,7-16,3 | 0,13 |
| III | 85,15-96,06 | 88 | 6 | 3,34 | 0,67-16,7 | 0,14 |
| IV | 96,15-168 | 92 | 2 | Ref. | Ref. | Ref. |
*wynik istotny statystycznie (p<0,05) P.438563
Powyższe wyniki stanowią przedmiot publikacji Rogoża-Janiszewska E. et al., Serum selenium level and the 10-year survival after melanoma, Biomedicines, 2021.[11]
Arsen i jego związki są jednymi z najbardziej rozpoznawalnych trucizn. Według klasyfikacji międzynarodowej agencji do badań nad rakiem (IARC, ang. International Agency for Cancer Research) arsen i jego związki zostały określone jako bezwzględne ludzkie karcynogeny – grupa 1.[12] Różnorodność objawów klinicznych wywołanych inhalacją związkami arsenu lub jego spożyciem jest bardzo duża. W zależności od stężenia, czasu ekspozycji i drogi zaabsorbowania skutki oddziaływania arsenu z tkankami są od stosunkowo niegroźnych na przykład hipopigmentacji, po zagrażające życiu nowotwory (WHO). W świetle istniejących danych literaturowych można stwierdzić, że nie tylko wysokie, ale i nieznacznie podwyższone stężenia arsenu mogą być przyczyną raków, zwłaszcza u kobiet.
Evaluation of the cancer risk in women - BRCA1 non-carriers
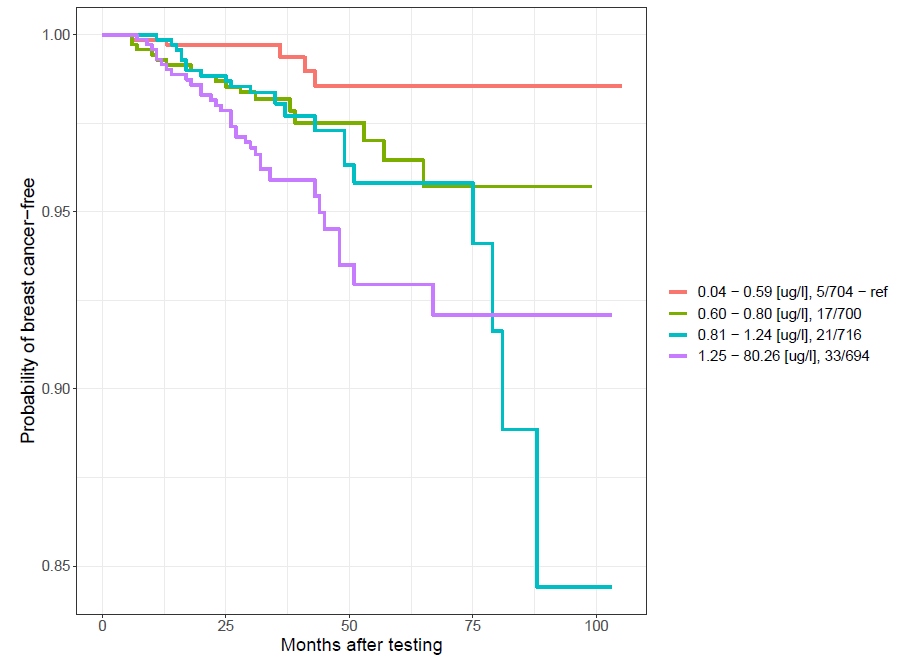
Kobiety ze stężeniem arsenu we krwi poniżej 0,6 µg/l wykazują istotne blisko 5-krotnie obniżone ryzyko rozwoju raków zwłaszcza raków piersi w porównaniu do kobiet ze stężeniem arsenu powyżej 0,6 µg/l (OR=4,7; p=0,0004; 95%CI:1,9-11,7).
Częstość występowania raków piersi w zależności od stężenia arsenu we krwi (wybrane zakresy)
| Grupa | Zakres stężeń µg/l | Osoby chore | Osoby zdrowe | OR | 95%CI | p |
| I | <0,6 | 5 | 735 | Ref. | Ref. | Ref. |
| II | 0,6-0,81 | 18 | 723 | 3,7 | 1,4-10 | 0,01* |
| III | 0,82-1,25 | 21 | 719 | 4,3 | 1,6-11-5 | 0,002* |
| IV | >1,25 | 32 | 709 | 6,6 | 2,6-17,1 | <0,0001* |
| Wybrane zakresy | ||||||
| I | <0,6 | 5 | 735 | Ref. | Ref. | Ref. |
| II | ≥0,6 | 71 | 2222 | 4,7 | 1,9-11,7 | 0,0004* |
*wynik istotny statystycznie (p <0,05) P.425602
Poniżej przedstawiono krzywą dla powyższej korelacji.

Probability of cancer-free – prawdopodobieństwo niezachorowania na raka/ Months after testing – czas obserwacji w miesiącach
Powyższe wyniki stanowią przedmiot publikacji Marciniak W. et al., Blood arsenic levels and the risk of familial breast cancer in Poland, Int J Cancer, 2020, 146 (10): 2721-2727.[13]
Evaluation of the cancer risk in women - BRCA1 carriers
Kobiety ze stężeniem arsenu we krwi poniżej 0,85 µg/l wykazują istotnie około 2-krotnie obniżone ryzyko rozwoju raka w porównaniu do kobiet ze stężeniem arsenu powyżej 0,85 µg/l (OR=2.55; p=0,0006; 95%CI:1,47-4,43).
Częstość występowania nowotworów w zależności od stężenia arsenu we krwi.
| Grupa | Zakres stężeń µg/l | Osoby chore | Osoby zdrowe | OR | 95%CI | p |
| I | <0,85 | 18 | 513 | Ref. | Ref. | Ref. |
| II | >0,85 | 49 | 548 | 2,55 | 1,47-4,43 | 0,0006* |
*wynik istotny statystycznie (p <0,05)
Powyższe wyniki stanowią część publikacji Marciniak W. et al., Blood Arsenic Levels as a Marker of Breast Cancer Risk among BRCA1 Carriers, Cancers 2021, 13(13), 3345. [14]
Evaluation of the cancer risk in men
Wśród mężczyzn, u których stężenie arsenu we krwi wynosi pomiędzy 0,7 a 1,14 µg/l wykazano blisko 5-krotnie obniżone ryzyko zachorowania na raka.
Częstość występowania raków u mężczyzn w zależności od stężenia arsenu we krwi (wybrane zakresy)
| Grupa | Zakres [µg/l] | >Osoby chore | Osoby zdrowe | OR | 95%CI | p |
| I | 0,7-1,14 | 28 | 788 | Ref. | Ref. | Ref. |
| II | <0,7 & > 1,14 | 116 | 2003 | 4,8 | 1,1-2,5 | 0,03* |
*wynik istotny statystycznie (p <0,05) P.437896
Survival of patients with prostate cancer
Mężczyźni ze stężeniem arsenu w surowicy w zakresie 0,7-1,0 µg/l wykazują istotnie ponad 3-krotnie zmniejszone ryzyko zgonu w stosunku do podgrupy ze stężeniem arsenu w surowicy < 0,7 µg/l.
Częstość zgonów w zależności od stężenia arsenu w surowicy u mężczyzn z rakiem prostaty w ciągu 5 lat od rozpoznania (wybrane zakresy).
| Grupa | Zakres [µg/l] | Zgony | Żyjący | OR | 95%CI | p |
| I | <0,7 | 22 | 50 | 3,18 | 1,63-6,22 | 0,0009* |
| II | 0,7-1,0 | 22 | 159 | Ref. | Ref. | Ref. |
| III | >1,0 | 21 | 83 | 1,83 | 0,95-3,52 | 0,085 |
*wynik istotny statystycznie (p <0,05) P.437046
Według IARC kadm i jego związki zostały określone jako bezwzględne ludzkie karcynogeny – grupa 1.[12] Niekorzystne działanie kadmu i jego związków może prowadzić do chorób nerek, sercowo-naczyniowych, nadciśnienia, anemii, uszkodzeń wątroby, zaburzeń funkcjonowania narządów płciowych, zaburzeń układu immunologicznego, niedoborów żelaza, miedzi i cynku, a także rozwinięcia choroby nowotworowej.[15] Liczne prace opisują zwiększone stężenia kadmu w materiale biologicznym osób, które zachorowały na raki prostaty[16,17], nerki[18], pęcherza moczowego[19,20], trzustki[21,22] i piersi[23,24].
W literaturze wymienia się trzy główne źródła kadmu: dieta, palenie tytoniu oraz ekspozycja zawodowa[25]. Stężenie kadmu w produktach spożywczych jest silnie zależne od zawartości tego pierwiastka w środowisku – powietrzu, glebie oraz wodzie[25]. Stężenie kadmu we krwi jest mocno skorelowane z paleniem wyrobów tytotniowych. U osób niepalących stężenie Cd jest niższe w porównaniu do palaczy[26]. Grupę zawodową bardziej narażoną na działanie kadmu stanowią pracownicy przemysłu cynkowego, stalowego i miedziowego oraz przy produkcji baterii niklowo-kadmowych, ogniw słonecznych i biżuterii[27].
Evaluation of the cancer risk in women - BRCA1 non-carriers
Poniższa tabela przedstawia rozkład osób badanych w wybranym przez nas zakresie. Ryzyko zachorowania na raka jest ponad 8-krotnie zmniejszone wśród kobiet, których stężenie znajduje się w zakresie 0,28-0,33 µg/l.
Częstość występowania raków w zależności od stężenia kadmu we krwi u kobiet nie palących powyżej 50 roku życia (wybrany zakres)
| Grupa | Zakres [µg/l] | Osoby chore | Osoby zdrowe | OR | 95%CI | p |
| I | 0,28-0,33 | 1 | 126 | Ref. | Ref. | Ref. |
| II | <0,28 & >0,33 | 44 | 665 | 8,34 | 1,1-61,1 | 0,009* |
*wynik istotny statystycznie (p <0,05) P.437608
Ocena ryzyka wystąpienia nowotworów złośliwych u kobiet z wykrytą mutacją w genie BRCA1
U kobiet poniżej 51 roku życia ze stężeniem kadmu we krwi ≤0,32 µg/l ryzyko zmniejszone jest ponad 8-krotnie w porównaniu do kobiet z wyższym poziomem kadmu.
Częstość występowania raków w zależności od stężenia kadmu we krwi u kobiet poniżej 51 roku życia (wybrany zakres)
| Grupa | Zakres [µg/l] | Osoby chore | Osoby zdrowe | OR | 95%CI | p |
| I | ≤0,32 | 1 | 92 | Ref. | Ref. | Ref. |
| II | >0,32 | 22 | 244 | 8,30 | 1,1-62,46 | 0,013* |
*wynik istotny statystycznie (p <0,05) PAT.237085
Powyższe wyniki stanowią przedmiot publikacji przesłanej do druku Derkacz R. et al., Blood Cadmium Level and the Risk of Cancer in Women with BRCA1 Mutations, Cancers, 2021.[28]
Evaluation of the cancer risk in men
Mężczyźni, którzy nigdy nie palili papierosów, u których stężenie kadmu we krwi wynosi < 0,14 µg/l mają blisko 6 krotnie obniżone ryzyko zachorowania na raka w stosunku do mężczyzn ze stężeniem kadmu we krwi > 0,28 µg/l.
Częstość występowania raków w zależności od stężenia kadmu we krwi u mężczyzn niepalących papierosów (ćwiartki)
| Ćwiartka | Zakres [µg/l] | Osoby chore | Osoby zdrowe | OR | 95%CI | p |
| I | 0,03-0,14 | 4 | 260 | Ref. | Ref. | Ref. |
| II | 0,14-0,21 | 7 | 257 | 1,77 | 0,51-6,12 | 0,54 |
| III | 0,21-0,28 | 15 | 249 | 3,92 | 1,28-11,96 | 0,02 |
| IV | 0,28-2,34 | 21 | 242 | 5,64 | 1,91-16,67 | 0,0004* |
*wynik istotny statystycznie (p <0,05)P.437897
Cynk jest pierwiastkiem niezbędnym dla prawidłowego funkcjonowania organizmu. Pełni funkcję ochronną przed wolnymi rodnikami, między innymi wchodząc w skład dysmutazy ponadtlenkowej (SOD2). Zaangażowany jest również w procesy immunologiczne, warunkuje prawidłową funkcję skóry czy też błon śluzowych. Bierze udział w magazynowaniu i wydzielaniu insuliny z trzustki, utrzymuje równowagę jonową innych mikroelementów, w tym selenu, magnezu czy miedzi, a także spełnia rolę detoksykacyjną w stosunku do metali ciężkich[29]. Niedobór tego pierwiastka prowadzi do poważnych zaburzeń takich jak: niedobory immunologiczne, zapalenia (m.in. SARS-Cov-2), nieprawidłowe gojenie ran, obniżenie płodności czy też problemy ze wzrokiem[29,30].
Zaobserwowano, że poziom cynku ulega zmianom w komórkach nowotworowych[31]. Prawidłowe komórki nabłonkowe prostaty akumulują cynk, zaś w komórkach rakowych poziom tego pierwiastka jest znacząco obniżony.[32] Uważa się, że cynk ma działanie przeciwnowotworowe hamując wzrost komórek nowotworowych i aktywując apoptozę. Znane są badania oceniające związek między stężeniem cynku a ryzykiem raków, ich wyniki są jednak rozbieżne. Niektóre z tych badań mówią, iż stężenie cynku w surowicy jest wyższe u osób z nowotworem [33–35], natomiast inne, że poziom ten jest niższy.[36] Wyniki przeprowadzonych do tej pory badań sugerują również, że odpowiednia ilość cynku w diecie działa chemoprewencyjnie. Osoby, których dieta jest bogata w cynk wykazują niższe ryzyko raka płuc niż osoby stosujące dietę ubogocynkową (OR 0,71; 95% CI 0,5-0,99). [37] Również ryzyko raka jelita grubego i odbytu jest niższe przy stosowaniu diety bogatocynkowej (RR 0,86; 95% CI 0,73-1,02).[38] Natomiast suplementacja cynkiem w bardzo wysokich dawkach powyżej 100 mg/dzień (zalecane dzienne spożycie cynku wynosi 8 mg/dzień dla kobiet a 12 mg/dzień dla mężczyzn) odnosi odwrotny efekt, znacząco zwiększając ryzyko wystąpienia raka prostaty (RR 2,29; 95% CI 1,06 – 4,95, p=0,03).[39] Poniżej przedstawiono wyniki badań przeprowadzonych w naszym Ośrodku.
Evaluation of the cancer risk in women - BRCA1 non-carriers
Kobiety niepalące, powyżej 50 roku życia ze stężeniem cynku we krwi w przedziale 5600-6100 µg/l mają 6,5 krotnie obniżone ryzyko zachorowania na raka w stosunku do kobiet ze stężeniem cynku poniżej 5600 µg/l, a 3,5 krotnie obniżone ryzyko w porównaniu do kobiet ze stężeniem cynku powyżej 6100 µg/l.
Częstość występowania raków w zależności od stężenia cynku we krwi u kobiet niepalących powyżej 50 roku życia
| Grupa | Zakres [µg/l] | Osoby chore | Osoby zdrowe | OR | 95%CI | p |
| I | <5600 | 20 | 198 | 6,5 | 1-89-22,12 | 0,0008* |
| II | 5600-6100 | 3 | 192 | Ref. | Ref. | Ref. |
| III | >6100 | 22 | 399 | 3,5 | 1,04-11,94 | 0,029 |
*wynik istotny statystycznie (p <0,05) P.437571
Evaluation of the cancer risk in women - BRCA1 carriers
Kobiety z mutacją w genie BRCA1, które nie paliły papierosów mają prawie 3 krotnie obniżone ryzyko zachorowania na raka, jeśli ich poziom cynku znajduje się w zakresie 6000-6700 µg/l. Takiej korelacji nie można stwierdzić wśród osób palących papierosy.
Częstość występowania raków w zależności od stężenia cynku we krwi u kobiet będących nosicielkami mutacji w genie BRCA1, które nie paliły papierosów (wybrane zakresy)
| Grupa | Zakres [µg/l] | Osoby chore | Osoby zdrowe | OR | 95%CI | p |
| I | 6000-6700 | 8 | 218 | Ref. | Ref. | Ref. |
| II | <6000&>6700 | 49 | 481 | 2,8 | 1,3-6,0 | 0,006* |
*wynik istotny statystycznie (p <0,05) P.425603
Evaluation of the cancer risk in men
Mężczyźni, którzy nie palili papierosów mają blisko 4 krotnie obniżone ryzyko zachorowania na raka, jeśli ich stężenie cynku we krwi zawiera się w przedziale 5600-6350 µg/l.
Częstość występowania raków w zależności od stężenia cynku we krwi u mężczyzn niepalących (wybrane zakresy)
| Ćwiartka | Zakres [µg/l] | Osoby chore | Osoby zdrowe | OR | 95%CI | p |
| I | 5600-6350 | 5 | 318 | Ref. | Ref. | Ref. |
| II | <5600&>6350 | 41 | 687 | 3,8 | 1,5-9,7 | 0,0018* |
*wynik istotny statystycznie (p <0,05) P.437894
Survival of patients with breast cancer
Kobiety ze zdiagnozowanym rakiem piersi oraz stężeniem cynku w surowicy > 1000 µg/l wykazują blisko 6-krotnie zmniejszone ryzyko zgonu w porównaniu do kobiet, u których to stężenie wynosi < 700 µg/l.
Tabela pokazuje częstość zgonów w zależności od stężenia cynku w surowicy u kobiet z rakiem piersi (n=538).
Częstość zgonów w zależności od stężenia cynku w surowicy u kobiet z rakiem piersi w ciągu 10 lat od rozpoznania (wybrane zakresy)
| Grupa | Zakres [µg/l] | Żyjący | Zgony | OR | 95%CI | p |
| I | ≤700 | 33 | 25 | 5,68 | 2,09-15,42 | 0,0003* |
| II | 700-850 | 181 | 54 | 2,24 | 0,91-5,53 | 0,088 |
| III | 851-1000 | 158 | 36 | 1,71 | 0,68-4,31 | 0,30 |
| IV | ≥1000 | 45 | 6 | Ref. | Ref. | Ref. |
*wynik istotny statystycznie (p <0,05) P.434767
Survival of patients with prostate cancer
Mężczyźni ze zdiagnozowanym rakiem prostaty, u których stężenie cynku w surowicy zawiera się w przedziale 1000-1200 µg/l wykazują prawie 4-krotnie zmniejszone ryzyko zgonu w stosunku do mężczyzn, u których stężenie to wynosi < 900 µg/l.
Częstość zgonów w zależności od stężenia cynku w surowicy u mężczyzn z rakiem prostaty w ciągu 5 lat od rozpoznania (ćwiartki)
| Grupa | Zakres [µg/l] | Żyjący | Zgony | OR | 95%CI | p |
| I | ≤760,38 | 56 | 34 | 8,4 | 3,31-21,33 | <0,0001* |
| II | 760,39-839,63 | 75 | 14 | 2,58 | 0,94-7,06 | 0,095 |
| III | 839,64-931,72 | 78 | 11 | 1,95 | 0,69-5,53 | 0,31 |
| IV | ≥931,73 | 83 | 6 | Ref. | Ref. | Ref. |
*wynik istotny statystycznie (p <0,05) P.437046
Wśród mężczyzn ze zdiagnozowanym rakiem prostaty, u których stężenie cynku w surowicy zawiera się w przedziale 1000-1200 zaobserwowano blisko 4-krotnie zmniejszone ryzyko zgonu, w stosunku do mężczyzn, u których stężenie cynku jest niższe niż 900 µg/l.
Częstość zgonów w zależności od stężenia cynku w surowicy u mężczyzn z rakiem prostaty ciągu 5 lat od rozpoznania (wybrane zakresy)
| Grupa | Zakres [µg/l] | Żyjący | Zgony | OR | 95%CI | p |
| I | <900 | 180 | 54 | 3,7 | 1,09-12,48 | 0,03* |
| II | 1000-1200 | 37 | 3 | Ref. | Ref. | Ref. |
*wynik istotny statystycznie (p <0,05) P.437046
Powyższe wyniki stanowią przedmiot zgłoszenia patentowego nr P.437046
Survival of patients with laryngeal cancer
Wśród osób z rakiem krtani ponad 2-krotnie zmniejszone ryzyko zgonu miały osoby chore ze stężeniem cynku powyżej 688 µg/l w surowicy w porównaniu do osób ze stężeniem <580 µg/l.
Częstość zgonów w zależności od stężenia cynku w surowicy u pacjentów z rakiem krtani w ciągu 5 lat od rozpoznania (tercyle)
| Grupa | Zakres µg/l] | Żyjący | Zgony | OR | 95%CI | p |
| I | 357,76-580,38 | 52 | 52 | 2,45 | 1,4-4,4 | <0,01* |
| II | 584,46-688,89 | 67 | 37 | 1,35 | 0,8-2,4 | 0,31 |
| III | 688,94-1317,87 | 76 | 31 | Ref. | Ref. | Ref. |
*wynik istotny statystycznie (p <0,05) P.427370
Powyższe wyniki stanowią przedmiot publikacji Lubiński J. et al., Survival of Laryngeal Cancer Patients Depending on Zinc Serum Level and Oxidative Stress Genotypes,Biomolecules2021, 11, 865.[40]
Miedź pełni różne funkcje w strukturze białek oraz jako katalizator dzięki zdolności do zmian stopnia utlenienia i redukcji i występuje w stanie utlenionym (Cu2+) lub zredukowanym (Cu+). Jony miedziowe mogą uczestniczyć w szerokim spektrum interakcji z białkami, umożliwiając powstawanie złożonych struktur oraz pośrednicząc w skomplikowanych reakcjach biochemicznych.[41,42] Miedź, podobnie jak inne pierwiastki śladowe, jest z jednej strony niezbędna dla organizmu, z drugiej jednak strony jest bardzo niebezpieczna. Generalnie jednak stany, które charakteryzują się ogólnym lub komórkowo-specyficznym nagromadzeniem miedzi zdarzają się rzadko i najczęściej występują w wyniku określonych zaburzeń o podłożu genetycznym.[43]
Evaluation of the cancer risk in women - BRCA1 non-carriers
Kobiety niepalące, w wieku poniżej 50 roku życia ze stężeniem miedzi we krwi pomiędzy 850-1000 µg/l mają niemal 3-krotnie zmniejszone ryzyko zachorowania na raka.
Częstość występowania raków u kobiet niepalących poniżej 50 roku życia, u których nie stwierdzono mutacji w genie BRCA1 (wybrane zakresy).
| Grupa | Zakres [µg/l] | Osoby chore | Osoby zdrowe | OR | 95%CI | p |
| I | 850-1000 | 16 | 493 | Ref. | Ref. | Ref. |
| II | <850 | 13 | 156 | 2,6 | 1,2-5,5 | 0,02* |
*wynik istotny statystycznie (p <0,05) P.438572
Zanieczyszczenie środowiska ołowiem stanowi nieustający problem dla rozwijających się społeczeństw. Toksyczne działanie ołowiu dotyczy głównie jego wpływu na układ krwiotwórczy[44], obwodowy i ośrodkowy układ nerwowy[45] oraz przewód pokarmowy[46]. Ze względu na wszechobecność ołowiu, praktycznie każdy człowiek narażony jest na kontakt z tym pierwiastkiem. Toksyczność ołowiu prowadzi między innymi do zmiany aktywności wielu enzymów oraz zaburzeń funkcji wolnych i strukturalnych białek w komórce[47]. Wiele badań sugeruje, że ważnym molekularnym mechanizmem toksyczności ołowiu jest jego udział w powstawaniu wolnych rodników tlenowych, które odgrywają dużą rolę w powstawaniu uszkodzeń wewnątrzkomórkowych oraz w patogenezie wielu schorzeń, w tym nowotworów złośliwych[48]. Według klasyfikacji karcynogenów IARC, ołów i jego związki należą do grupy 2a i 2b tj. potencjalnie karcinogennych[12].
Evaluation of the cancer risk in women - BRCA1 non-carriers
Kobiety, ze stężeniem ołowiu we krwi ≤ 8 µg/l, wykazują istotnie blisko 9-krotnie zmniejszone ryzyko rozwoju raka.
Częstość występowania nowotworów w zależności od stężenia ołowiu u kobiet. (wybrane zakresy).
| Grupa | Zakres [µg/l] | Osoby chore | Osoby zdrowe | OR | 95%CI | p |
| I | ≤8 | 1 | 372 | Ref. | Ref. | Ref. |
| II | >8 | 26 | 1094 | 8,84 | 1,2-65,41 | 0,006* |
*wynik istotny statystycznie (p <0,05) P.433150
Evaluation of the cancer risk in women - BRCA1 carriers
Kobiety, ze stężeniem ołowiu we krwi ≤ 8 µg/l, wykazują istotnie 3-krotnie zmniejszone ryzyko rozwoju raka.
Częstość występowania nowotworów w zależności od stężenia ołowiu u kobiet. (wybrane zakresy).
| Grupa | Zakres [µg/l] | Osoby chore | Osoby zdrowe | OR | 95%CI | p |
| I | ≤8 | 8 | 217 | Ref. | Ref. | Ref. |
| II | >8 | 87 | 812 | 2,9 | 1,4-6,1 | 0,002* |
*wynik istotny statystycznie (p <0,05) P.433150
Evaluation of the cancer risk in men
Mężczyźni poniżej 60 roku życia, niepalący wykazują blisko 8-krotnie obniżone ryzyko zachorowania, jeśli ich stężenie ołowiu jest niższe niż 13,5 µg/l.
Częstość występowania nowotworów w zależności od stężenia ołowiu u mężczyzn niepalących poniżej 60 roku życia (wybrane zakresy).
| Grupa | Zakres [µg/l] | Osoby chore | Osoby zdrowe | OR | 95%CI | p |
| I | <13,5 | 1 | 217 | Ref. | Ref. | Ref. |
| II | >13,5 | 16 | 447 | 7,8 | 1,02-59,0 | 0,017* |
*wynik istotny statystycznie (p <0,05) P.437899
Mężczyźni powyżej 60 roku życia, niepalący wykazują 4-krotnie obniżone ryzyko zachorowania na nowotwory, jeśli ich stężenie ołowiu zawiera się w przedziale 20-50 µg/l we krwi pełnej.
Częstość występowania nowotworów w zależności od stężenia ołowiu u mężczyzn niepalących powyżej 60 roku życia (wybrane zakresy).
| Grupa | Zakres [µg/l] | Osoby chore | Osoby zdrowe | OR | 95%CI | p |
| I | 20-50 | 3 | 74 | Ref. | Ref. | Ref. |
| II | <20 & >50 | 15 | 90 | 4,1 | 1,1-14,8 | 0,02* |
wynik istotny statystycznie (p <0,05) P.437899
Mangan (Mn) jest niezbędnym składnikiem odżywczym biorącym udział w prawidłowym funkcjonowaniu układu odpornościowego, regulacji poziomu cukru we krwi i energii komórkowej, rozmnażania, trawienia, wzrostu kości, krzepnięcia krwi i homeostazy oraz obrony przed reaktywnymi formami tlenu. Funkcje pełnione przez metaloproteiny manganu obejmują oksyreduktazy, transferazy, hydrolazy, liazy, izomerazy oraz ligazy. [49] Mn działa jako kofaktor dla różnych enzymów, w tym arginazy, syntetazy glutaminy (GS), karboksylazy pirogronianowej i dysmutazy ponadtlenkowej Mn (Mn-SOD) [50]. Mn ma tendencję do odkładania się w wątrobie, trzustce, kościach oraz mózgu [50].
W literaturze można znaleźć badania opisujące korelację pomiędzy stężeniem Mn w surowicy a ryzykiem raka piersi oraz jelita grubego. Opublikowane badania mają jednak charakter retrospektywny co powoduje, że nie są one wiarygodne dla stwierdzenia, że mangan jest markerem ryzyka zachorowania na raka. W naszym Ośrodku oceniliśmy korelację pomiędzy stężeniem manganu a przeżyciami kobiet z rakiem piersi.
Survival of patients with breast cancer
Kobiety ze zdiagnozowanym rakiem piersi, u których stężenie manganu w surowicy zawiera się w przedziale 1-10 µg/l, wykazują istotnie ponad 1,5 krotnie zmniejszone ryzyko zgonu w odniesieniu do pozostałych kobiet.
Częstość zgonów w zależności od stężenia manganu w surowicy u kobiet z rakiem piersi w ciągu 10 lat od rozpoznania (wybrane zakresy).
| Grupa | Zakres µg/l | Żyjący | Zgony | HR | 95%CI | p |
| I | 1,0-10,0 | 197 | 49 | Ref. | Ref. | Ref. |
| II | <1 & > 10 | 204 | 87 | 1,55 | 1,09-2,20 | 0,01* |
*wynik istotny statystycznie (p <0,05) P.438040
Chrom (Cr) należy do pierwiastków szeroko rozpowszechnionych w skorupie ziemskiej. Pierwiastek ten w niewielkich ilościach jest niezbędny dla prawidłowego funkcjonowania organizmu pełniąc rolę w przemianach metabolicznych glukozy, niektórych białek i tłuszczów [51–53]. Zwiększone dawki chromu mogą mieć silne działanie toksyczne, wpływając destrukcyjnie na wątrobę, nerki i układ krwiotwórczy oraz powodując nowotwory [51,54,55]. Stwierdzono, że Cr(VI) wykazuje silne działanie mutagenne. Wyniki badań asocjacyjnych wskazują na związek pomiędzy stężeniem chromu we krwi oraz ryzykiem nowotworów w obrębie głowy, szyi i jamy ustnej.
W naszym Ośrodku wykonano pracę nad korelacją pomiędzy stężeniem chromu w surowicy a przeżyciem kobiet ze zdiagnozowanym rakiem piersi.
Survival of patients with breast cancer
Kobiety ze zdiagnozowanym rakiem piersi, u których stężenie chromu w surowicy zawiera się w przedziale 0,20-3,5 µg/l, wykazują istotnie blisko 2 krotnie zmniejszone ryzyko zgonu.
Częstość zgonów w zależności od stężenia chromu w surowicy u kobiet z rakiem piersi w ciągu 10 lat od rozpoznania (wybrane zakresy).
| Grupa | Zakres µg/l | Żyjący | Zgony | HR | 95%CI | p |
| I | 0,20-3,5 | 202 | 54 | Ref. | Ref. | Ref. |
| II | <0,20 & > 3,5 | 199 | 82 | 1,8 | 1,28-2,54 | 0,0002* |
*wynik istotny statystycznie (p <0,05) P.438042
Kobiety palące papierosy, u których zdiagnozowano nowotwór złośliwy piersi, wykazują istotnie blisko 4,5 krotnie zmniejszone ryzyko zgonu, jeśli ich stężenie chromu w surowicy jest wyższe niż 0,5 µg/l.
Częstość zgonów w zależności od stężenia chromu w surowicy u kobiet palących z rakiem piersi w ciągu 10 lat od rozpoznania (wybrane zakresy).
| Grupa | Zakres µg/l | Żyjący | Zgony | HR | 95%CI | p |
| I | <0,5 | 157 | 56 | 4,46 | 1,39-14,26 | 0,01* |
| II | ≥0,5 | 38 | 3 | Ref. | Ref. | Ref. |
*wynik istotny statystycznie (p <0,05) P.438042
Norms
Pierwiastek | Grupa | Podgrupa | Norma [µg/l] | Publikacja/ Nr zgłoszenia patentowego |
Selenium | Kobiety BRCA1 (-) | Palenie (-); < 60 r.ż. Palenie (-); > 60 r.ż. Palenie (+) | 100-110 94-104 110-120 | P.438038 |
| Kobiety BRCA1 (+) | < 50 r.ż. > 50 r.ż. | 70-80 95-120 | P.435603 |
| men | Palenie (-) Palenie (+); < 60 r.ż. Palenie (+); > 60 r.ż. | 100-110 NZ* 115-130 | P.437898 |
Arsenic | Kobiety BRCA1 (-) | – | < 0,6 | Marciniak W., 2020[13] P.425602 |
| Kobiety BRCA1 (+) | – | < 0,85 | Marciniak W., 2021[14] |
| men | – | 0,7-1,14 | P.437896 |
Cadmium | Kobiety BRCA1 (-) | Palenie (-) < 50 r.ż. Palenie (-) > 50 r.ż. Palenie (+) | NZ* 0,28-0,33 NZ* | P.437608 |
| Kobiety BRCA1 (+) | Palenie (-) Palenie (+) | < 0,27 NZ* | Derkacz R, 2021[28] PAT.237085 |
| men | Palenie (-) Palenie (+) | < 0,21 NZ* | P.437897 |
Zinc | Kobiety BRCA1 (-) | Palenie (-); < 50 r.ż. Palenie (-); > 50 r.ż. Palenie (+) | NZ* 5600-6100 NZ* | P.437571 |
| Kobiety BRCA1 (+) | Palenie (-) Palenie (+) | 6000-6700 6400-6800 | P.425603 |
| men | Palenie (-) Palenie (+) | 5700-6350 NZ* | P.437894 |
Copper | Kobiety BRCA1 (-) | < 50 r.ż. > 50 r.ż. | 850-1000 < 1000 | P.438572 |
| Kobiety BRCA1 (+) | Palenie (-);< 50 r.ż. Palenie (-); > 50 r.ż. Palenie (+) | 750-825 < 1000 < 1000 | |
| men | – | < 800 | P.437895 |
Lead | Kobiety BRCA1 (-) | – | ≤ 7,5 | P.438655 |
| Kobiety BRCA1 (+) | – | < 8 | P.433150 |
| men | Palenie (-); < 60 r.ż. Palenie (-); > 60 r.ż. Palenie (+) | < 13,5 < 50 NZ* | P.437899 |
- NZ – dotychczas nie znaleziono korelacji pomiędzy stężeniem pierwiastka a ryzykiem raków w tej podgrupie klinicznej
- Kobiety BRCA1 (-) – kobiety bez wykrytej mutacji w genie BRCA1
- Kobiety BRCA1 (+) – kobiety z wykrytą mutacją w genie BRCA1
- Palenie (-) – osoby niepalące papierosów
- Palenie (+) – osoby palące papierosy
| Pierwiastek | Grupa | Norma [µg/l] | >Publikacja/Nr zgłoszenia patentowego |
| Selenium | Kobiety Mężczyźni | 95-102,5 | Lener M, 2016[10]; Lubiński JA, 2018 [56]; Lubiński J, 20118n [57];Pietrzak S, 2019[9]; Szwiec M, 2021[8]; Rogoża-Janiszewska E., 2021[11]; P.437046 |
| Arsenic | men | 0,75-1,0 | P.437046 |
| Zinc | Kobiety Mężczyźni | 1025-1175 | Lubiński J, 2021[40]; P.434767; P.437046 |
| Copper | Kobiety Mężczyźni | <1000 ≤ 900 | P.436999 |
| Chromium | women | >0,5 | P.438042 |
| Manganese | women | 1-10 | P.438040 |
- Hariharan, S.; Dharmaraj, S. Selenium and Selenoproteins: It’s Role in Regulation of Inflammation. Inflammopharmacology 2020, 28, 667–695, doi:10.1007/s10787-020-00690-x.
- Combs, G.F.; Clark, L.C.; Turnbull, B.W. An Analysis of Cancer Prevention by Selenium. Biofactors 2001, 14, 153–159, doi:10.1002/biof.5520140120.
- Reddy, V.N.; Giblin, F.J.; Lin, L.R.; Dang, L.; Unakar, N.J.; Musch, D.C.; Boyle, D.L.; Takemoto, L.J.; Ho, Y.S.; Knoernschild, T.; et al. Glutathione Peroxidase-1 Deficiency Leads to Increased Nuclear Light Scattering, Membrane Damage, and Cataract Formation in Gene-Knockout Mice. Invest Ophthalmol Vis Sci 2001, 42, 3247–3255.
- Kuria, A.; Fang, X.; Li, M.; Han, H.; He, J.; Aaseth, J.O.; Cao, Y. Does Dietary Intake of Selenium Protect against Cancer? A Systematic Review and Meta-Analysis of Population-Based Prospective Studies. Crit Rev Food Sci Nutr 2020, 60, 684–694, doi:10.1080/10408398.2018.1548427.
- Jenkins, D.J.A.; Kitts, D.; Giovannucci, E.L.; Sahye-Pudaruth, S.; Paquette, M.; Blanco Mejia, S.; Patel, D.; Kavanagh, M.; Tsirakis, T.; Kendall, C.W.C.; et al. Selenium, Antioxidants, Cardiovascular Disease, and All-Cause Mortality: A Systematic Review and Meta-Analysis of Randomized Controlled Trials. Am J Clin Nutr 2020, 112, 1642–1652, doi:10.1093/ajcn/nqaa245.
- Schomburg, L. The Other View: The Trace Element Selenium as a Micronutrient in Thyroid Disease, Diabetes, and Beyond. Hormones (Athens) 2020, 19, 15–24, doi:10.1007/s42000-019-00150-4.
- Kenfield, S.A.; Van Blarigan, E.L.; DuPre, N.; Stampfer, M.J.; L Giovannucci, E.; Chan, J.M. Selenium Supplementation and Prostate Cancer Mortality. J Natl Cancer Inst 2015, 107, 360, doi:10.1093/jnci/dju360.
- Szwiec, M.; Marciniak, W.; Derkacz, R.; Huzarski, T.; Gronwald, J.; Cybulski, C.; Dębniak, T.; Jakubowska, A.; Lener, M.; Falco, M.; et al. Serum Selenium Level Predicts 10-Year Survival after Breast Cancer. Nutrients 2021, 13, 953, doi:10.3390/nu13030953.
- Pietrzak, S.; Wójcik, J.; Scott, R.J.; Kashyap, A.; Grodzki, T.; Baszuk, P.; Bielewicz, M.; Marciniak, W.; Wójcik, N.; Dębniak, T.; et al. Influence of the Selenium Level on Overall Survival in Lung Cancer. J Trace Elem Med Biol 2019, 56, 46–51, doi:10.1016/j.jtemb.2019.07.010.
- Lener, M.R.; Scott, R.J.; Wiechowska-Kozłowska, A.; Serrano-Fernández, P.; Baszuk, P.; Jaworska-Bieniek, K.; Sukiennicki, G.; Marciniak, W.; Muszyńska, M.; Kładny, J.; et al. Serum Concentrations of Selenium and Copper in Patients Diagnosed with Pancreatic Cancer. Cancer Res Treat 2016, 48, 1056–1064, doi:10.4143/crt.2015.282.
- Rogoża-Janiszewska E. et al Serum Selenium Level and the 10-Year Survival after Melanoma. Biomedicines SI: Role of Trace Elements in Chemoprevention and Cancer Therapy 2021.
- List of Classifications – IARC Monographs on the Identification of Carcinogenic Hazards to Humans Available online: https://monographs.iarc.who.int/list-of-classifications/ (accessed on 20 July 2021).
- Marciniak, W.; Derkacz, R.; Muszyńska, M.; Baszuk, P.; Gronwald, J.; Huzarski, T.; Cybulski, C.; Jakubowska, A.; Falco, M.; Dębniak, T.; et al. Blood Arsenic Levels and the Risk of Familial Breast Cancer in Poland. Int J Cancer 2020, 146, 2721–2727, doi:10.1002/ijc.32595.
- Marciniak, W.; Matoušek, T.; Domchek, S.; Paradiso, A.; Patruno, M.; Irmejs, A.; Roderte, I.; Derkacz, R.; Baszuk, P.; Kuświk, M.; et al. Blood Arsenic Levels as a Marker of Breast Cancer Risk among BRCA1 Carriers. Cancers 2021, 13, 3345, doi:10.3390/cancers13133345.
- Fowler, B.A. Monitoring of Human Populations for Early Markers of Cadmium Toxicity: A Review. Toxicol Appl Pharmacol 2009, 238, 294–300, doi:10.1016/j.taap.2009.05.004.
- Vinceti, M.; Venturelli, M.; Sighinolfi, C.; Trerotoli, P.; Bonvicini, F.; Ferrari, A.; Bianchi, G.; Serio, G.; Bergomi, M.; Vivoli, G. Case-Control Study of Toenail Cadmium and Prostate Cancer Risk in Italy. Sci Total Environ 2007, 373, 77–81, doi:10.1016/j.scitotenv.2006.11.005.
- Qayyum, M.A.; Shah, M.H. Comparative Study of Trace Elements in Blood, Scalp Hair and Nails of Prostate Cancer Patients in Relation to Healthy Donors. Biol Trace Elem Res 2014, 162, 46–57, doi:10.1007/s12011-014-0123-4.
- Pirincci, N.; Gecit, I.; Gunes, M.; Kaba, M.; Tanik, S.; Yuksel, M.B.; Arslan, H.; Demir, H. Levels of Serum Trace Elements in Renal Cell Carcinoma Cases. Asian Pac J Cancer Prev 2013, 14, 499–502, doi:10.7314/apjcp.2013.14.1.499.
- Kellen, E.; Zeegers, M.P.; Hond, E.D.; Buntinx, F. Blood Cadmium May Be Associated with Bladder Carcinogenesis: The Belgian Case-Control Study on Bladder Cancer. Cancer Detect Prev 2007, 31, 77–82, doi:10.1016/j.cdp.2006.12.001.
- Wolf, C.; Strenziok, R.; Kyriakopoulos, A. Elevated Metallothionein-Bound Cadmium Concentrations in Urine from Bladder Carcinoma Patients, Investigated by Size Exclusion Chromatography-Inductively Coupled Plasma Mass Spectrometry. Anal Chim Acta 2009, 631, 218–222, doi:10.1016/j.aca.2008.10.035.
- Farzin, L.; Moassesi, M.E.; Sajadi, F.; Ahmadi Faghih, M.A. Evaluation of Trace Elements in Pancreatic Cancer Patients in Iran. Middle East Journal of Cancer 2013, 4, 79–86.
- Amaral, A.F.S.; Porta, M.; Silverman, D.T.; Milne, R.L.; Kogevinas, M.; Rothman, N.; Cantor, K.P.; Jackson, B.P.; Pumarega, J.A.; López, T.; et al. Pancreatic Cancer Risk and Levels of Trace Elements. Gut 2012, 61, 1583–1588, doi:10.1136/gutjnl-2011-301086.
- Wu, H.-D.I.; Chou, S.-Y.; Chen, D.-R.; Kuo, H.-W. Differentiation of Serum Levels of Trace Elements in Normal and Malignant Breast Patients. Biol Trace Elem Res 2006, 113, 9–18, doi:10.1385/BTER:113:1:19.
- Deeb, M.; El-Sheredy, H.; Mohammed, A. The Role of Serum Trace Elements and Oxidative Stress in Egyptian Breast Cancer Patients. Advances in Breast Cancer Research 2016, 05, 37–47, doi:10.4236/abcr.2016.51004.
- Sabir, S.; Akash, M.S.H.; Fiayyaz, F.; Saleem, U.; Mehmood, M.H.; Rehman, K. Role of Cadmium and Arsenic as Endocrine Disruptors in the Metabolism of Carbohydrates: Inserting the Association into Perspectives. Biomed Pharmacother 2019, 114, 108802, doi:10.1016/j.biopha.2019.108802.
- Lee, J.-E.; Kim, H.-R.; Lee, M.; Kim, N.-H.; Wang, K.-M.; Lee, S.; Park, O.; Hong, E.-J.; Youn, J.-W.; Kim, Y.-Y. Smoking-Related DNA Methylation Is Differentially Associated with Cadmium Concentration in Blood. Biochem Genet 2020, 58, 617–630, doi:10.1007/s10528-020-09965-y.
- Bolam, T.; Bersuder, P.; Burden, R.; Shears, G.; Morris, S.; Warford, L.; Thomas, B.; Nelson, P. Cadmium Levels in Food Containing Crab Brown Meat: A Brief Survey from UK Retailers. Journal of Food Composition and Analysis 2016, 54, 63–69, doi:10.1016/j.jfca.2016.10.005.
- Derkacz R. et al. Blood Cadmium Level and the Risk of Cancer in Women with BRCA1 Mutations. Cancers, SI: Advances in Inherited Breast and Ovarian Cancer and Its Imaging 2021.
- Nasiadek, M.; Stragierowicz, J.; Klimczak, M.; Kilanowicz, A. The Role of Zinc in Selected Female Reproductive System Disorders. Nutrients 2020, 12, 2464, doi:10.3390/nu12082464.
- Puzanowska-Tarasiewicz, H.; Kuźmicka, L.; Tarasiewicz, M. Funkcje biologiczne wybranych pierwiastków i ich związków. 3, 3,. Polski Merkuriusz Lekarski : organ Polskiego Towarzystwa Lekarskiego. 2009, 419–422.
- To, P.K.; Do, M.H.; Cho, J.-H.; Jung, C. Growth Modulatory Role of Zinc in Prostate Cancer and Application to Cancer Therapeutics. Int J Mol Sci 2020, 21, E2991, doi:10.3390/ijms21082991.
- Zaichick VYe, null; Sviridova, T.V.; Zaichick, S.V. Zinc in the Human Prostate Gland: Normal, Hyperplastic and Cancerous. Int Urol Nephrol 1997, 29, 565–574, doi:10.1007/BF02552202.
- Siddiqui, M.K.J.; Jyoti, null; Singh, S.; Mehrotra, P.K.; Singh, K.; Sarangi, R. Comparison of Some Trace Elements Concentration in Blood, Tumor Free Breast and Tumor Tissues of Women with Benign and Malignant Breast Lesions: An Indian Study. Environ Int 2006, 32, 630–637, doi:10.1016/j.envint.2006.02.002.
- Pasha, Q.; Malik, S.A.; Shah, M.H. Statistical Analysis of Trace Metals in the Plasma of Cancer Patients versus Controls. J Hazard Mater 2008, 153, 1215–1221, doi:10.1016/j.jhazmat.2007.09.115.
- el-Ahmady, O.; el-Maraghy, A.; Ibrahim, A.; Ramzy, S. Serum Copper, Zinc, and Iron in Patients with Malignant and Benign Pulmonary Diseases. Nutrition 1995, 11, 498–501.
- Kuo, H.W.; Chen, S.F.; Wu, C.C.; Chen, D.R.; Lee, J.H. Serum and Tissue Trace Elements in Patients with Breast Cancer in Taiwan. Biol Trace Elem Res 2002, 89, 1–11, doi:10.1385/BTER:89:1:1.
- Zhou, W.; Park, S.; Liu, G.; Miller, D.P.; Wang, L.I.; Pothier, L.; Wain, J.C.; Lynch, T.J.; Giovannucci, E.; Christiani, D.C. Dietary Iron, Zinc, and Calcium and the Risk of Lung Cancer. Epidemiology 2005, 16, 772–779, doi:10.1097/01.ede.0000181311.11585.59.
- Zhang, X.; Giovannucci, E.L.; Smith-Warner, S.A.; Wu, K.; Fuchs, C.S.; Pollak, M.; Willett, W.C.; Ma, J. A Prospective Study of Intakes of Zinc and Heme Iron and Colorectal Cancer Risk in Men and Women. Cancer Causes Control 2011, 22, 1627–1637, doi:10.1007/s10552-011-9839-z.
- Leitzmann, M.F.; Stampfer, M.J.; Wu, K.; Colditz, G.A.; Willett, W.C.; Giovannucci, E.L. Zinc Supplement Use and Risk of Prostate Cancer. J Natl Cancer Inst 2003, 95, 1004–1007, doi:10.1093/jnci/95.13.1004.
- Lubiński, J.; Jaworowska, E.; Derkacz, R.; Marciniak, W.; Białkowska, K.; Baszuk, P.; Scott, R.J.; Lubiński, J.A. Survival of Laryngeal Cancer Patients Depending on Zinc Serum Level and Oxidative Stress Genotypes. Biomolecules 2021, 11, 865, doi:10.3390/biom11060865.
- Festa, R.A.; Thiele, D.J. Copper: An Essential Metal in Biology. Curr Biol 2011, 21, R877-883, doi:10.1016/j.cub.2011.09.040.
- Ceramella, J.; Mariconda, A.; Iacopetta, D.; Saturnino, C.; Barbarossa, A.; Caruso, A.; Rosano, C.; Sinicropi, M.S.; Longo, P. From Coins to Cancer Therapy: Gold, Silver and Copper Complexes Targeting Human Topoisomerases. Bioorg Med Chem Lett 2020, 30, 126905, doi:10.1016/j.bmcl.2019.126905.
- Linder, M.C. The Relationship of Copper to DNA Damage and Damage Prevention in Humans. Mutat Res 2012, 733, 83–91, doi:10.1016/j.mrfmmm.2012.03.010.
- Johnson, F.M. The Genetic Effects of Environmental Lead. Mutat Res 1998, 410, 123–140, doi:10.1016/s1383-5742(97)00032-x.
- Marchetti, C. Molecular Targets of Lead in Brain Neurotoxicity. Neurotox Res 2003, 5, 221–236, doi:10.1007/BF03033142.
- Tomczyk, J.; Lewczuk, E.; Abdrzejak, R. Ostre Zatrucia Organicznymi Związkammi Ołowiu.; Medycyna Pracy, 1999; Vol. 50;.
- Cellular Mechanisms of Lead Neurotoxicity – PubMed Available online: https://pubmed.ncbi.nlm.nih.gov/16501435/ (accessed on 20 July 2021).
- Nersesyan, A.; Kundi, M.; Waldherr, M.; Setayesh, T.; Mišík, M.; Wultsch, G.; Filipic, M.; Mazzaron Barcelos, G.R.; Knasmueller, S. Results of Micronucleus Assays with Individuals Who Are Occupationally and Environmentally Exposed to Mercury, Lead and Cadmium. Mutat Res 2016, 770, 119–139, doi:10.1016/j.mrrev.2016.04.002.
- Aschner, M.; Erikson, K. Manganese. Adv Nutr 2017, 8, 520–521, doi:10.3945/an.117.015305.
- Chen, P. Manganese Metabolism in Humans. Front Biosci 2018, 23, 1655–1679, doi:10.2741/4665.
- Bagchi, D.; Stohs, S.J.; Downs, B.W.; Bagchi, M.; Preuss, H.G. Cytotoxicity and Oxidative Mechanisms of Different Forms of Chromium. Toxicology 2002, 180, 5–22, doi:10.1016/s0300-483x(02)00378-5.
- Cefalu, W.T.; Hu, F.B. Role of Chromium in Human Health and in Diabetes. Diabetes Care 2004, 27, 2741–2751, doi:10.2337/diacare.27.11.2741.
- Vincent, J.B. The Biochemistry of Chromium. J Nutr 2000, 130, 715–718, doi:10.1093/jn/130.4.715.
- Anderson, R.A. Chromium Metabolism and Its Role in Disease Processes in Man. Clin Physiol Biochem 1986, 4, 31–41.
- Anderson, R.A. Chromium as an Essential Nutrient for Humans. Regul Toxicol Pharmacol 1997, 26, S35-41, doi:10.1006/rtph.1997.1136.
- Lubinski, J.; Marciniak, W.; Muszynska, M.; Huzarski, T.; Gronwald, J.; Cybulski, C.; Jakubowska, A.; Debniak, T.; Falco, M.; Kladny, J.; et al. Serum Selenium Levels Predict Survival after Breast Cancer. Breast Cancer Res Treat 2018, 167, 591–598, doi:10.1007/s10549-017-4525-9.
- Lubiński, J.; Marciniak, W.; Muszynska, M.; Jaworowska, E.; Sulikowski, M.; Jakubowska, A.; Kaczmarek, K.; Sukiennicki, G.; Falco, M.; Baszuk, P.; et al. Serum Selenium Levels and the Risk of Progression of Laryngeal Cancer. PLoS One 2018, 13, e0184873, doi:10.1371/journal.pone.0184873.
Home » Research
Research
Research projects
Prevention of Hereditary Breast Cancer through Personalized Optimization of Se, Zn, Fe Levels in the Body Using Dietary Supplements
Agreement No. INNOMED/I/16/NCBR/2014
Project Duration as per the Agreement: 01.10.2014-30.09.2019. The project co-financed by the European Union under the European Regional Development Fund
The project partner is the West Pomeranian University of Technology in Szczecin
Characteristics of the studied groups
The study groups, whose analyses form the basis for the results described below, were created from individuals registered in the Hereditary Cancer Center in Szczecin between 2009 and 2020. Each patient provided informed consent for the storage and use of biological material for scientific purposes. Blood and serum samples were collected between 8 AM and 2 PM, and patients fasted for at least 4 hours before collection. For the majority of patients, a sample was collected only once, but in some cases, multiple samples were taken during subsequent visits. Biological material was stored at -80°C until the element concentrations were determined. Each participant in the study completed a health and lifestyle questionnaire.
A total of 2962 healthy women were included in the prospective cohort. During 42 months of follow-up, 148 women were diagnosed with cancer.
The characteristics of the group are presented in the table.
| Cases (n=148) | Healthy (n=2814) |
Average age (range) | 56,46 (35-82) | 53 (33-84) |
Smoking current former never |
40 (27,03%) 34 (22,97%) 74 (50 %) |
605 (21,50%) 750 (26,65%) 1459 (51,84%) |
Hormone replacement therapy / oral contraceptives no yes missing data |
93 (62,84%) 54 (36,49%) 1 (0,67%) |
1467 (52,13%) 1316 (46,77%) 31 (1,1%) |
Adnexektomia no yes missing data |
135 (91,22%) 9 (6,08%) 4 (2,7%) |
2631 (93,50%) 175 (6,22%) 8 (0,28%) |
Cancers (location) breast uterus colon melanoma thyroid ovary cervix lymphoma bladder lung kidney stomach leukemia myeloma glioblastoma pancreas |
76 (51,4%) 12 (8,1%) 10 (6,8%) 7 (4,7%) 7 (7,73%) 6 (4,05%) 5 (3,38%) 5 (3,38%) 4 (2,7%) 4 (2,7%) 3 (2,03%) 3 (2,03%) 2 (1,35%) 2 (1,35%) 1 (0,68%) 1 (0,68%) |
– – – – – – – – – – – – – – – – |
Do kohorty prospektywnej włączono 1324 zdrowe (bez zdiagnozowanego nowotworu złośliwego) kobiety, u których wykryto mutację w genie BRCA1. Uczestniczki zostały poddane średnio 40 miesięcznej obserwacji, w trakcie której u 107 kobiet zdiagnozowano nowotwór złośliwy.
The characteristics of the group are presented in the table.
| Cases (n=107) | Healthy (n=1217) |
Average age (range) | 44,25 (26-66) | 40,5 (25-69) |
Smoking current former never missing data |
24 (22,43%) 27 (25,23%) 55 (51,4%) 1 (0,93%) |
254 (20,87%) 249 (20,46%) 699 (57,44%) 15 (1,23%) |
Hormone replacement therapy / oral contraceptives no yes missing data |
46 (43%) 60 (56,07%) 1 (0,93%) |
603 (49,55%) 592 (48,64%) 22 (1,81%) |
Adnexektomia no yes missing data |
52 (48,6%) 55 (51,4%) 0 |
688 (56,53%) 510 (41,92%) 19 (1,56%) |
Cancers (location) breast ovary cervix peritoneum stomach colon leukemia pancreas skin larynx thyroid bladder |
80 (74,8%) 15 (14%) 3 (2,8%) 1 (0,9%) 1 (0,9%) 1 (0,9%) 1 (0,9%) 1 (0,9%) 1 (0,9%) 1 (0,9%) 1 (0,9%) 1 (0,9%) |
– – – – – – – – – – – – |
Do kohorty prospektywnej włączono zdrowych (bez zdiagnozowanego nowotworu złośliwego) 2956 mężczyzn. Zostali oni poddani średnio 76 miesięcznej obserwacji, w trakcie której u 144 mężczyzn zdiagnozowano nowotwór złośliwy. Każdy z uczestników badania wypełnił ankietę o stanie zdrowia oraz stylu życia.
Charakterystykę grupy prospektywnej przedstawiono w poniższej tabeli.
| Cases (n=144) | Healthy (n=2812) |
Average age (range) | 60,5 (36-76) | 52 (31-87) |
Smoking current former never |
42 (29,17%) 55 (38,19%) 47 (32,64 %) |
829 (29,48%) 975 (34,67%) 1008 (35,85%) |
Cancers (location) prostate skin kidney colon bladder blood lung liver thyroid pancreas stomach breast esophagus pituitary gland salivary glands testis |
58 (40,28%) 16 (11,11%) 13 (9,03%) 13 (9,03%) 12 (8,33%) 9 (6,25%) 6 (4,17%) 4 (2,78%) 4 (2,78%) 2 (1,39%) 2 (1,39%) 1 (0,69%) 1 (0,69%) 1 (0,69%) 1 (0,69%) 1 (0,69%) |
– – – – – – – – – – – – – – – – |
Do badań włączono 538 pacjentek ze zdiagnozowanym i potwierdzonym histopatologicznie rakiem piersi. Krew została zebrana w latach 2009-2015 w momencie diagnozy raka piersi, przed rozpoczęciem leczenia. W 2020 roku zebrano informację o zgonach w trakcie obserwacji prospektywnej. Uzyskano ją z Departamentu Ewidencji Państwowych – Ministerstwa Cyfryzacji. Średni okres obserwacji dla pacjentek żyjących wyniósł 9 lat (zakres 5-12 lat).
Charakterystyka grupy została przedstawiona w poniższej tabeli.
| Alive (n=417) | Deaths (n=121) |
Average age (range) | 55,87 (25-85) | 61,07 (28-91) |
Smoking current former never missing data |
89 (21,3%) 112 (26,9%) 206 (49,4%) 10 (2,4%) |
26 (21,5%) 27 (22,3%) 65 (53,7%) 3 (2,5%) |
Estrogen receptor positive (ER+) negative (ER-) missing data |
287 (68,8%) 114 (27,3%) 16 (3,8%) |
79 (65,3%) 32 (26,4%) 10 (8,26%) |
BRCA1 mutation | 50 (12%) | 11 (9,1%) |
Chemotherapy yes no missing data |
211 (50,6%) 174 (41,7%) 32 (7,7%) |
65 (53,7%) 36 (29,8%) 20 (16,5%) |
Radiotherapy yes no missing data |
244 (58,5%) 122 (29,3%) 51 (12,2%) |
56 (46,3%) 35 (28,9%) 30 (24,8%) |
Tamoxifen yes no missing data |
282 (67,6%) 122 (29,3%) 13 (3,1%) |
79 (65,3%) 33 (27,3%) 9 (7,4%) |
Type of operation mastectomy lumpectomy missing data |
261 (62,6%) 131 (31,4%) 25 (6%) |
82 (67,8%) 17 (14%) 22 18,2%) |
The study included 357 patients with diagnosed and histopathologically confirmed prostate cancer. Blood was collected between 2009 and 2015 at the time of diagnosis of prostate cancer before treatment. The average follow-up period for patients was 5 years.
| Alive (n=293) | Deaths (n=102) |
Gleason scale 6 7 8 9 10 missing data |
85 (29%) 164 (56%) 20 (6,8%) 17 (5,8%) 2 (0,7%) 5 (1,7%) |
39 (38,2%) 35 (34,3%) 9 (8,8%) 11 (10,8%) 7 (6,9%) 2 (1,96%) |
Clinical stage 1-2 3 4 missing data |
7 (2,7%) 232 (79,2%) 51 (17,4%) 2 (0,7%) |
4 (3,9%) 45 (44,1%) 53 (52%) – |
Radiotherapy yes no |
84 (28,7%) 209 (71,3%) |
24 (23,5%) 78 (76,5%) |
Chemotherapy yes no |
3 (1%) 290 (99%) |
4 (3,9%) 98 (96,1%) |
Hormonetherapy yes no |
59 (20,1%) 234 (79,9%) |
40 (39,2%) 62 (60,8%) |
Prostatectomy yes no |
233 (79,5%) 60 (20,5%) |
33 (32,4%) 69 (67,6%) |
Orchidectomy yes no |
8 (2,7%) 285 (97,3%) |
11 (10,8%) 91 89,2%) |
The group included 315 patients treated surgically between July 2009 and February 2017 due to squamous cell carcinoma of the larynx. The patients constituted over 70% of all patients operated on at the Otolaryngology Clinic of the Pomeranian Medical University in Szczecin. Clinical information was collected from all patients regarding age at onset, gender, clinical stage, radiotherapy, chemotherapy and smoking intensity (pack-years).
| n=315 | % |
Average age of cancer diagnosis (range) | 61,1 (41-86) |
|
Sex women men |
49 266 |
15,6 84,4 |
Clinical stage 1 2 3 4 |
72 42 70 131 |
22,8 13,3 22,2 41,6 |
Pack-years (average, range) | 37,11 (0-150) |
|
Treatment radiotherapy chemotherapy |
142 32 |
45,1 10,1 |
The study group consisted of 302 patients diagnosed with lung cancer. The patients came from the Department of Thoracic Surgery in Szczecin-Zdunowo. Patients were hospitalized between February 2010 and December 2011. Blood was collected at the time of diagnosis, before the start of treatment.
|
| % |
Sex
men women |
196 106 |
64,9 35,1 |
Average age (range) | 64,2 (43-86) | – |
Pack-years (range) | 33,2 (0-232,8) | – |
Smoking
yes no |
283 19 |
93,7 6,3 |
Clinical stage 1 2 3 4 |
129 75 79 19 |
42,7 24,8 26,2 6,3 |
Radiotherapy
yes no |
78 224 |
25,8 74,2 |
Chemotherapy
yes no |
105 197 |
34,8 65,2 |
Histological type
Adenocarcinoma Squamous cell carcinoma Large cell cancer Large and Small Cell Mixed Carcinoma Small Cell Carcinoma Other |
136 124 21 5 3 13 |
45 41,1 7 1,7 1 4,3 |
Do grupy badanej włączono 100 pacjentów z rakiem trzustki.
Charakterystyka grupy została przedstawiona w poniższej tabeli.
| Osoby chore |
Year of birth (range) | 1930-1976 |
Average age at the blood donation (range) | 63,4 (35-84) |
Sex
men women |
59 41 |
First-Degree Relatives
with pancreatic cancer with other cancer |
4 43 |
Smoking
yes no |
27 73 |
Pack-years (range) | 28,99 (2-50) |
Do grupy włączono 375 pacjentów ze zdiagnozowanym czerniakiem złośliwym zdiagnozowanych w latach 2006-2016. Krew pacjentów została zabezpieczona w momencie diagnozy, przed rozpoczęciem leczenia.
Charakterystyka grupy badanej została przedstawiona w poniższej tabeli.
| Alive (n=344) | Deaths (n=31) |
Average age (range) | 54,6 (21-90) | 64,3 (38-86) |
Sex women men |
218 (63%) 126 (37%) |
14 (45%) 17 (55%) |
Clinical stage 2 3 4-5 |
70 (20%) 145 (42%) 129 (38%) |
1 (3,2%) 12 (39%) 18 (58%) |
Research results
W organizmie selen działa poprzez białka, do których jest wbudowany w postaci selenocysteiny. Jako składnik selenobiałek selen odgrywa rolę enzymatyczną, jak i strukturalną[1]. Do jednych z ważniejszych funkcji selenobiałek należy udział w produkcji hormonów tarczycy, pobudzanie układu immunologicznego, oraz ochrona przed stresem oksydacyjnym.[2] Zarówno niedobór jak i nadmiar tego pierwiastka może mieć niekorzystny wpływ na organizm. Prowadzi to do m.in. do zaburzeń pracy serca, zwyrodnienia serca i wątroby, zwiększenia ryzyka choroby nadciśnieniowej, ograniczenia sprawności układu odpornościowego, zaburzenia funkcji tarczycy, zaburzenia mineralizacji kości i prawidłowego wykształcenia zębów oraz zwiększenia ryzyka chorób nowotworowych. [3–7]
Ocena ryzyka wystąpienia nowotworów złośliwych u kobiet bez wykrytej mutacji w genie BRCA1
Kobiety powyżej 60 roku życia, niepalące mają istotnie 4,5 krotnie obniżone ryzyko, jeśli mają stężenie we krwi zawierające się w przedziale 94-104 µg/l. Natomiast kobiety powyżej 60 roku życia, które palą obecnie bądź paliły w przeszłości mają istotnie 3,5 krotnie obniżone ryzyko zachorowania na raka, jeśli mają stężenie selenu we krwi > 110 µg/l.
Częstość występowania raków u kobiet niepalących, powyżej 60 roku życia (wybrane zakresy).
Grupa | Zakres [µg/l] | Osoby chore | Osoby zdrowe | OR | 95%CI | p |
I | 94-104 | 3 | 114 | Ref. | Ref. | Ref. |
II | <94 | 11 | 93 | 4,5 | 1,2-16,6 | 0,02* |
*wynik istotny statystycznie (p <0,05) P.438038
Częstość występowania raków u kobiet palących, powyżej 60 roku życia (wybrane zakresy).
Grupa | Zakres [µg/l] | Osoby chore | Osoby zdrowe | OR | 95%CI | p |
I | >110 | 4 | 97 | Ref. | Ref. | Ref. |
II | <110 | 25 | 171 | 3,5 | 1,2-10,5 | 0,02* |
*wynik istotny statystycznie (p <0,05) P.438038
Ocena ryzyka wystąpienia nowotworów złośliwych u kobiet z wykrytą mutacją w genie BRCA1
Kobiety, poniżej 50 roku życia, ze stężeniem selenu we krwi zawierającym się w przedziale 70-80 µg/l, mają tendencję do blisko 5 krotnie obniżonego ryzyka raka w porównaniu do kobiet ze stężeniami selenu poza przedstawionym przedziałem.
Częstość występowania raków w zależności od stężenia selenu we krwi wśród kobiet poniżej 50 roku życia (wybrane zakresy).
Grupa | Zakres [µg/l] | Osoby chore | Osoby zdrowe | OR | 95%CI | p |
I | 70-80 | 1 | 56 | Ref. | Ref. | Ref. |
II | <70 & >80 | 75 | 904 | 4,6 | 0,6-34,1 | 0,1* |
*wynik nieistotny statystycznie (p >0,05) P.435603
Kobiety, powyżej 50 roku życia, ze stężeniem selenu we krwi zawierającym się w przedziale 95-120 µg/l wykazują ponad 2 krotnie obniżone ryzyko zachorowania na raka w porównaniu do kobiet ze stężeniami selenu poza przedstawionym przedziałem.
Częstość występowania raków w zależności od stężenia selenu we krwi wśród kobiet powyżej 50 roku życia (wybrane zakresy).
Grupa | Zakres [µg/l] | Osoby chore | Osoby zdrowe | OR | 95%CI | p |
I | 95-120 | 13 | 156 | Ref. | Ref. | Ref. |
II | <95 & >120 | 20 | 102 | 2,3 | 1,1-4,9 | 0,03* |
*wynik istotny statystycznie (p <0,05) P.435603
Ocena ryzyka wystąpienia nowotworów złośliwych u mężczyzn
Mężczyźni niepalący papierosów, ze stężeniem selenu we krwi zawierającym się w przedziale 100-110 µg/l wykazują blisko 4 krotnie obniżone ryzyko zachorowania na raka w porównaniu do mężczyzn ze stężeniami selenu poza tym przedziałem.
Częstość występowania raków w zależności od stężenia selenu we krwi wśród mężczyzn niepalących (wybrane zakresy).
Grupa | Zakres [µg/l] | Osoby chore | Osoby zdrowe | OR | 95%CI | p |
I | 100-110 | 5 | 260 | Ref. | Ref. | Ref. |
II | <95 | 20 | 291 | 3,6 | 1,3-9,7 | 0,008* |
*wynik istotny statystycznie (p <0,05) P.437898
Natomiast mężczyźni powyżej 60 roku życia oraz palący papierosy w przeszłości bądź obecnie wykazują blisko 11 krotnie zmniejszone ryzyko zachorowania na nowotwór złośliwy, w przypadku występowania stężenia selenu we krwi >115 µg/l, w porównaniu do mężczyzn ze stężeniem selenu we krwi <115 µg/l.
Częstość występowania raków w zależności od stężenia selenu we krwi wśród mężczyzn palących powyżej 60 roku życia (wybrane zakresy).
Grupa | Zakres [µg/l] | Osoby chore | Osoby zdrowe | OR | 95%CI | p |
I | <115 | 1 | 83 | Ref. | Ref. | Ref. |
II | ≥115 | 56 | 427 | 10,9 | 1,5-79,8 | 0,0013* |
*wynik istotny statystycznie (p <0,05) P.437898
Poniżej przedstawiono krzywą Kaplana-Meier’a dla powyższej korelacji.

Probability of cancer-free – prawdopodobieństwo niezachorowania na raka
Months after testing – czas obserwacji w miesiącach
Survival of patients with breast cancer
Kobiety z rakiem piersi mają istotnie większą szansę na 10-letnie przeżycie, jeśli ich stężenie selenu w surowicy wynosi >94,7 µg/l. Kobiety ze stężeniem selenu w surowicy < 70 µg/l mają ponad 25-krotnie zwiększone ryzyko zgonu w porównaniu z podgrupą o stężeniu selenu w surowicy 95-102,5 µg/l.
Częstość zgonów w zależności od stężenia selenu w surowicy u kobiet z rakiem piersi w ciągu 10 lat od rozpoznania (ćwiartki).
Ćwiartki | Zakres [µg/l] | Żyjący | Zgony | HR | 95%CI | p |
I | 52,1-76,7 | 89 | 46 | 2,35 | 1,12-4,55 | 0,01* |
II | 76,8-85,1 | 105 | 29 | 1,52 | 0,76-3,02 | 0,23 |
III | 85,2-94,6 | 105 | 29 | 1,95 | 1,01-3,76 | 0,047* |
IV | 94,7-171,5 | 118 | 17 | Ref. | Ref. | Ref. |
*wynik istotny statystycznie (p <0,05)
Częstość zgonów w zależności od stężenia selenu w surowicy u kobiet z rakiem piersi w ciągu 10 lat od rozpoznania (zakresy).
Ćwiartki | Zakres [µg/l] | Żyjący | Zgony | OR | 95%CI | p |
I | < 70 | 32 | 28 | Ref. | Ref. | Ref. |
II | 95-102,5 | 62 | 2 | 27,1 | 6,7-121,2 | <0,0001* |
*wynik istotny statystycznie (p <0,05)
Powyższe wyniki stanowią część publikacji Szwiec M et al., Serum Selenium Level Predicts 10-Years Survival after Breast Cancer; Nutrients 2021, 13(3), 953. [8]
Survival of patients with prostate cancer
Mężczyźni z rakiem prostaty oraz stężeniem selenu w surowicy w zakresie 85-105 µg/l wykazują istotnie ponad 8 krotnie zmniejszone ryzyko zgonu w stosunku do podgrupy ze stężeniem selenu w surowicy poniżej 70 µg/l.
Częstość zgonów w zależności od stężenia selenu w surowicy u mężczyzn z rakiem prostaty w ciągu 5 lat od rozpoznania (wybrane zakresy).
Grupa | Zakres [µg/l] | Żyjący | Zgony | OR | 95%CI | p |
I | ≤70 | 61 | 33 | 8,6 | 3,4-21,7 | <0,0001* |
II | 85-105 | 95 | 6 | Ref. | Ref. | Ref. |
*wynik istotny statystycznie (p <0,05) P.437046
Survival of patients with lung cancer
Zaobserwowano, że większe szanse na dłuższe przeżycie po diagnozie raka płuca maja osoby, u których stężenie selenu w surowicy wynosi >67,4 µg/l w porównaniu do osób o niskim stężeniu tego pierwiastka w surowicy (<55,1 µg/l).
Częstość zgonów w zależności od stężenia selenu w surowicy u pacjentów z rakiem płuca w I stopniu zaawansowania w ciągu 3 lat od rozpoznania (tertyle).
Tertyle | Zakres [µg/l] | Ilość osób | OR | 95%CI | p |
I | 33,46-57,91 | 43 | 2,73 | 1,21-6,11 | 0,01* |
II | 57,92-68,86 | 42 | 1,88 | 0,83-4,28 | 0,13 |
III | 69,29-108,27 | 44 | Ref. | Ref. | Ref. |
*wynik istotny statystycznie (p <0,05)
Powyższe wyniki stanowią część publikacji Pietrzak S. et al., Influence of the selenium level on overall survival in lung cancer, Journal of Trace Elements in Medicine and Biology 2019, 56:46-51.[9]
Survival of patients with pancreatic cancer
Pacjenci ze zdiagnozowanym rakiem trzustki mają 3-krotnie większą szansę na 6-miesięczne przeżycie, jeśli ich stężenie selenu w surowicy jest ≥ 63,67 µg/l w porównaniu do pacjentów ze stężeniem selenu poniżej tej wartości.
Częstość zgonów w zależności od stężenia selenu w surowicy u pacjentów z rakiem trzustki w ciągu 6 miesięcy od rozpoznania (wybrane zakresy).
Grupa | Zakres [µg/l] | Żyjący | Zgony | OR | 95%CI | p |
I | < 63,67 | 24 | 33 | 0,4 | 0,1-0,97 | 0,03* |
II | ≥ 63,67 | 22 | 11 | Ref. | Ref. | Ref. |
Powyższe wyniki stanowią część publikacji Lener M. et al., Serum concentration of Selenium and Copper in Patients Diagnosed with Pancreatic Cancer, Cancer Res Treat., 2016, 48(3):1056-1064.[10]
Survival of patients with melanoma
Pacjenci ze zdiagnozowanym czerniakiem złośliwym mają istotnie większą szansę na 10-lecie przeżycie, jeśli ich stężenie selenu w surowicy jest wyższe niż 96 µg/l. Pacjenci ze stężeniem selenu w surowicy < 76 µg/l mają blisko 6-krotnie zwiększone ryzyko zgonu w porównaniu z podgrupą o stężeniu selenu w surowicy > 96 µg/l.
Częstość zgonów w zależności od stężenia selenu w surowicy u pacjentów z czerniakiem złośliwym w ciągu 10 lat od rozpoznania (ćwiartki).
Ćwiartki | Zakres [µg/l] | Żyjący | Zgony | HR | 95%CI | p |
I | 56,7-76,2 | 78 | 16 | 5,83 | 1,32-25,8 | 0,02* |
II | 76,4-85,01 | 86 | 7 | 3,37 | 0,7-16,3 | 0,13 |
III | 85,15-96,06 | 88 | 6 | 3,34 | 0,67-16,7 | 0,14 |
IV | 96,15-168 | 92 | 2 | Ref. | Ref. | Ref. |
*wynik istotny statystycznie (p<0,05) P.438563
Powyższe wyniki stanowią przedmiot publikacji Rogoża-Janiszewska E. et al., Serum selenium level and the 10-year survival after melanoma, Biomedicines, 2021.[11]
Arsen i jego związki są jednymi z najbardziej rozpoznawalnych trucizn. Według klasyfikacji międzynarodowej agencji do badań nad rakiem (IARC, ang. International Agency for Cancer Research) arsen i jego związki zostały określone jako bezwzględne ludzkie karcynogeny – grupa 1.[12] Różnorodność objawów klinicznych wywołanych inhalacją związkami arsenu lub jego spożyciem jest bardzo duża. W zależności od stężenia, czasu ekspozycji i drogi zaabsorbowania skutki oddziaływania arsenu z tkankami są od stosunkowo niegroźnych na przykład hipopigmentacji, po zagrażające życiu nowotwory (WHO). W świetle istniejących danych literaturowych można stwierdzić, że nie tylko wysokie, ale i nieznacznie podwyższone stężenia arsenu mogą być przyczyną raków, zwłaszcza u kobiet.
Evaluation of the cancer risk in women - BRCA1 non-carriers
Kobiety ze stężeniem arsenu we krwi poniżej 0,6 µg/l wykazują istotne blisko 5-krotnie obniżone ryzyko rozwoju raków zwłaszcza raków piersi w porównaniu do kobiet ze stężeniem arsenu powyżej 0,6 µg/l (OR=4,7; p=0,0004; 95%CI:1,9-11,7).
Częstość występowania raków piersi w zależności od stężenia arsenu we krwi (wybrane zakresy)
Grupa | Zakres stężeń µg/l | Osoby chore | Osoby zdrowe | OR | 95%CI | p |
I | <0,6 | 5 | 735 | Ref. | Ref. | Ref. |
II | 0,6-0,81 | 18 | 723 | 3,7 | 1,4-10 | 0,01* |
III | 0,82-1,25 | 21 | 719 | 4,3 | 1,6-11-5 | 0,002* |
IV | >1,25 | 32 | 709 | 6,6 | 2,6-17,1 | <0,0001* |
Wybrane zakresy | ||||||
I | <0,6 | 5 | 735 | Ref. | Ref. | Ref. |
II | ≥0,6 | 71 | 2222 | 4,7 | 1,9-11,7 | 0,0004* |
*wynik istotny statystycznie (p <0,05) P.425602
Poniżej przedstawiono krzywą dla powyższej korelacji.

Probability of cancer-free – prawdopodobieństwo niezachorowania na raka
Months after testing – czas obserwacji w miesiącach
Powyższe wyniki stanowią przedmiot publikacji Marciniak W. et al., Blood arsenic levels and the risk of familial breast cancer in Poland, Int J Cancer, 2020, 146 (10): 2721-2727.[13]
Evaluation of the cancer risk in women - BRCA1 carriers
Kobiety ze stężeniem arsenu we krwi poniżej 0,85 µg/l wykazują istotnie około 2-krotnie obniżone ryzyko rozwoju raka w porównaniu do kobiet ze stężeniem arsenu powyżej 0,85 µg/l (OR=2.55; p=0,0006; 95%CI:1,47-4,43).
Częstość występowania nowotworów w zależności od stężenia arsenu we krwi.
Grupa | Zakres stężeń µg/l | Osoby chore | Osoby zdrowe | OR | 95%CI | p |
I | <0,85 | 18 | 513 | Ref. | Ref. | Ref. |
II | >0,85 | 49 | 548 | 2,55 | 1,47-4,43 | 0,0006* |
*wynik istotny statystycznie (p <0,05)
Powyższe wyniki stanowią część publikacji Marciniak W. et al., Blood Arsenic Levels as a Marker of Breast Cancer Risk among BRCA1 Carriers, Cancers 2021, 13(13), 3345. [14]
Evaluation of the cancer risk in men
Wśród mężczyzn, u których stężenie arsenu we krwi wynosi pomiędzy 0,7 a 1,14 µg/l wykazano blisko 5-krotnie obniżone ryzyko zachorowania na raka.
Częstość występowania raków u mężczyzn w zależności od stężenia arsenu we krwi (wybrane zakresy)
Grupa | Zakres [µg/l] | Osoby chore | Osoby zdrowe | OR | 95%CI | p |
I | 0,7-1,14 | 28 | 788 | Ref. | Ref. | Ref. |
II | <0,7 & > 1,14 | 116 | 2003 | 4,8 | 1,1-2,5 | 0,03* |
*wynik istotny statystycznie (p <0,05) P.437896
Survival of patients with prostate cancer
Mężczyźni ze stężeniem arsenu w surowicy w zakresie 0,7-1,0 µg/l wykazują istotnie ponad 3-krotnie zmniejszone ryzyko zgonu w stosunku do podgrupy ze stężeniem arsenu w surowicy < 0,7 µg/l.
Częstość zgonów w zależności od stężenia arsenu w surowicy u mężczyzn z rakiem prostaty w ciągu 5 lat od rozpoznania (wybrane zakresy).
Grupa | Zakres [µg/l] | Zgony | Żyjący | OR | 95%CI | p |
I | <0,7 | 22 | 50 | 3,18 | 1,63-6,22 | 0,0009* |
II | 0,7-1,0 | 22 | 159 | Ref. | Ref. | Ref. |
III | >1,0 | 21 | 83 | 1,83 | 0,95-3,52 | 0,085 |
*wynik istotny statystycznie (p <0,05) P.437046
Według IARC kadm i jego związki zostały określone jako bezwzględne ludzkie karcynogeny – grupa 1.[12] Niekorzystne działanie kadmu i jego związków może prowadzić do chorób nerek, sercowo-naczyniowych, nadciśnienia, anemii, uszkodzeń wątroby, zaburzeń funkcjonowania narządów płciowych, zaburzeń układu immunologicznego, niedoborów żelaza, miedzi i cynku, a także rozwinięcia choroby nowotworowej.[15] Liczne prace opisują zwiększone stężenia kadmu w materiale biologicznym osób, które zachorowały na raki prostaty[16,17], nerki[18], pęcherza moczowego[19,20], trzustki[21,22] i piersi[23,24].
W literaturze wymienia się trzy główne źródła kadmu: dieta, palenie tytoniu oraz ekspozycja zawodowa[25]. Stężenie kadmu w produktach spożywczych jest silnie zależne od zawartości tego pierwiastka w środowisku – powietrzu, glebie oraz wodzie[25]. Stężenie kadmu we krwi jest mocno skorelowane z paleniem wyrobów tytotniowych. U osób niepalących stężenie Cd jest niższe w porównaniu do palaczy[26]. Grupę zawodową bardziej narażoną na działanie kadmu stanowią pracownicy przemysłu cynkowego, stalowego i miedziowego oraz przy produkcji baterii niklowo-kadmowych, ogniw słonecznych i biżuterii[27].
Evaluation of the cancer risk in women - BRCA1 non-carriers
Poniższa tabela przedstawia rozkład osób badanych w wybranym przez nas zakresie. Ryzyko zachorowania na raka jest ponad 8-krotnie zmniejszone wśród kobiet, których stężenie znajduje się w zakresie 0,28-0,33 µg/l.
Częstość występowania raków w zależności od stężenia kadmu we krwi u kobiet nie palących powyżej 50 roku życia (wybrany zakres)
| Grupa | Zakres [µg/l] | Osoby chore | Osoby zdrowe | OR | 95%CI | p |
| I | 0,28-0,33 | 1 | 126 | Ref. | Ref. | Ref. |
| II | <0,28 & >0,33 | 44 | 665 | 8,34 | 1,1-61,1 | 0,009* |
*wynik istotny statystycznie (p <0,05) P.437608
Ocena ryzyka wystąpienia nowotworów złośliwych u kobiet z wykrytą mutacją w genie BRCA1
U kobiet poniżej 51 roku życia ze stężeniem kadmu we krwi ≤0,32 µg/l ryzyko zmniejszone jest ponad 8-krotnie w porównaniu do kobiet z wyższym poziomem kadmu.
Częstość występowania raków w zależności od stężenia kadmu we krwi u kobiet poniżej 51 roku życia (wybrany zakres)
| Grupa | Zakres [µg/l] | Osoby chore | Osoby zdrowe | OR | 95%CI | p |
| I | ≤0,32 | 1 | 92 | Ref. | Ref. | Ref. |
| II | >0,32 | 22 | 244 | 8,30 | 1,1-62,46 | 0,013* |
*wynik istotny statystycznie (p <0,05) PAT.237085
Powyższe wyniki stanowią przedmiot publikacji przesłanej do druku Derkacz R. et al., Blood Cadmium Level and the Risk of Cancer in Women with BRCA1 Mutations, Cancers, 2021.[28]
Evaluation of the cancer risk in men
Mężczyźni, którzy nigdy nie palili papierosów, u których stężenie kadmu we krwi wynosi < 0,14 µg/l mają blisko 6 krotnie obniżone ryzyko zachorowania na raka w stosunku do mężczyzn ze stężeniem kadmu we krwi > 0,28 µg/l.
Częstość występowania raków w zależności od stężenia kadmu we krwi u mężczyzn niepalących papierosów (ćwiartki)
| Ćwiartka | Zakres [µg/l] | Osoby chore | Osoby zdrowe | OR | 95%CI | p |
| I | 0,03-0,14 | 4 | 260 | Ref. | Ref. | Ref. |
| II | 0,14-0,21 | 7 | 257 | 1,77 | 0,51-6,12 | 0,54 |
| III | 0,21-0,28 | 15 | 249 | 3,92 | 1,28-11,96 | 0,02 |
| IV | 0,28-2,34 | 21 | 242 | 5,64 | 1,91-16,67 | 0,0004* |
*wynik istotny statystycznie (p <0,05)P.437897
Cynk jest pierwiastkiem niezbędnym dla prawidłowego funkcjonowania organizmu. Pełni funkcję ochronną przed wolnymi rodnikami, między innymi wchodząc w skład dysmutazy ponadtlenkowej (SOD2). Zaangażowany jest również w procesy immunologiczne, warunkuje prawidłową funkcję skóry czy też błon śluzowych. Bierze udział w magazynowaniu i wydzielaniu insuliny z trzustki, utrzymuje równowagę jonową innych mikroelementów, w tym selenu, magnezu czy miedzi, a także spełnia rolę detoksykacyjną w stosunku do metali ciężkich[29]. Niedobór tego pierwiastka prowadzi do poważnych zaburzeń takich jak: niedobory immunologiczne, zapalenia (m.in. SARS-Cov-2), nieprawidłowe gojenie ran, obniżenie płodności czy też problemy ze wzrokiem[29,30].
Zaobserwowano, że poziom cynku ulega zmianom w komórkach nowotworowych[31]. Prawidłowe komórki nabłonkowe prostaty akumulują cynk, zaś w komórkach rakowych poziom tego pierwiastka jest znacząco obniżony.[32] Uważa się, że cynk ma działanie przeciwnowotworowe hamując wzrost komórek nowotworowych i aktywując apoptozę. Znane są badania oceniające związek między stężeniem cynku a ryzykiem raków, ich wyniki są jednak rozbieżne. Niektóre z tych badań mówią, iż stężenie cynku w surowicy jest wyższe u osób z nowotworem [33–35], natomiast inne, że poziom ten jest niższy.[36] Wyniki przeprowadzonych do tej pory badań sugerują również, że odpowiednia ilość cynku w diecie działa chemoprewencyjnie. Osoby, których dieta jest bogata w cynk wykazują niższe ryzyko raka płuc niż osoby stosujące dietę ubogocynkową (OR 0,71; 95% CI 0,5-0,99). [37] Również ryzyko raka jelita grubego i odbytu jest niższe przy stosowaniu diety bogatocynkowej (RR 0,86; 95% CI 0,73-1,02).[38] Natomiast suplementacja cynkiem w bardzo wysokich dawkach powyżej 100 mg/dzień (zalecane dzienne spożycie cynku wynosi 8 mg/dzień dla kobiet a 12 mg/dzień dla mężczyzn) odnosi odwrotny efekt, znacząco zwiększając ryzyko wystąpienia raka prostaty (RR 2,29; 95% CI 1,06 – 4,95, p=0,03).[39] Poniżej przedstawiono wyniki badań przeprowadzonych w naszym Ośrodku.
Ocena ryzyka wystąpienia nowotworów złośliwych u kobiet bez wykrytej mutacji w genie BRCA1
Kobiety niepalące, powyżej 50 roku życia ze stężeniem cynku we krwi w przedziale 5600-6100 µg/l mają 6,5 krotnie obniżone ryzyko zachorowania na raka w stosunku do kobiet ze stężeniem cynku poniżej 5600 µg/l, a 3,5 krotnie obniżone ryzyko w porównaniu do kobiet ze stężeniem cynku powyżej 6100 µg/l.
Częstość występowania raków w zależności od stężenia cynku we krwi u kobiet niepalących powyżej 50 roku życia
Grupa | Zakres [µg/l] | Osoby chore | Osoby zdrowe | OR | 95%CI | p |
I | <5600 | 20 | 198 | 6,5 | 1-89-22,12 | 0,0008* |
II | 5600-6100 | 3 | 192 | Ref. | Ref. | Ref. |
III | >6100 | 22 | 399 | 3,5 | 1,04-11,94 | 0,029 |
*wynik istotny statystycznie (p <0,05) P.437571
Ocena ryzyka wystąpienia nowotworów złośliwych u kobiet z wykrytą mutacją w genie BRCA1
Kobiety z mutacją w genie BRCA1, które nie paliły papierosów mają prawie 3 krotnie obniżone ryzyko zachorowania na raka, jeśli ich poziom cynku znajduje się w zakresie 6000-6700 µg/l. Takiej korelacji nie można stwierdzić wśród osób palących papierosy.
Częstość występowania raków w zależności od stężenia cynku we krwi u kobiet będących nosicielkami mutacji w genie BRCA1, które nie paliły papierosów (wybrane zakresy)
Grupa | Zakres [µg/l] | Osoby chore | Osoby zdrowe | OR | 95%CI | p |
I | 6000-6700 | 8 | 218 | Ref. | Ref. | Ref. |
II | <6000&>6700 | 49 | 481 | 2,8 | 1,3-6,0 | 0,006* |
*wynik istotny statystycznie (p <0,05) P.425603
Ocena ryzyka wystąpienia nowotworów złośliwych u mężczyzn
Mężczyźni, którzy nie palili papierosów mają blisko 4 krotnie obniżone ryzyko zachorowania na raka, jeśli ich stężenie cynku we krwi zawiera się w przedziale 5600-6350 µg/l.
Częstość występowania raków w zależności od stężenia cynku we krwi u mężczyzn niepalących (wybrane zakresy)
Ćwiartka | Zakres [µg/l] | Osoby chore | Osoby zdrowe | OR | 95%CI | p |
I | 5600-6350 | 5 | 318 | Ref. | Ref. | Ref. |
II | <5600&>6350 | 41 | 687 | 3,8 | 1,5-9,7 | 0,0018* |
*wynik istotny statystycznie (p <0,05) P.437894
Survival of patients with breast cancer
Kobiety ze zdiagnozowanym rakiem piersi oraz stężeniem cynku w surowicy > 1000 µg/l wykazują blisko 6-krotnie zmniejszone ryzyko zgonu w porównaniu do kobiet, u których to stężenie wynosi < 700 µg/l.
Tabela pokazuje częstość zgonów w zależności od stężenia cynku w surowicy u kobiet z rakiem piersi (n=538).
Częstość zgonów w zależności od stężenia cynku w surowicy u kobiet z rakiem piersi w ciągu 10 lat od rozpoznania (wybrane zakresy)
Grupa | Zakres [µg/l] | Żyjący | Zgony | OR | 95%CI | p |
I | ≤700 | 33 | 25 | 5,68 | 2,09-15,42 | 0,0003* |
II | 700-850 | 181 | 54 | 2,24 | 0,91-5,53 | 0,088 |
III | 851-1000 | 158 | 36 | 1,71 | 0,68-4,31 | 0,30 |
IV | ≥1000 | 45 | 6 | Ref. | Ref. | Ref. |
*wynik istotny statystycznie (p <0,05) P.434767
Survival of patients with prostate cancer
Mężczyźni ze zdiagnozowanym rakiem prostaty, u których stężenie cynku w surowicy zawiera się w przedziale 1000-1200 µg/l wykazują prawie 4-krotnie zmniejszone ryzyko zgonu w stosunku do mężczyzn, u których stężenie to wynosi < 900 µg/l.
Częstość zgonów w zależności od stężenia cynku w surowicy u mężczyzn z rakiem prostaty w ciągu 5 lat od rozpoznania (ćwiartki)
Grupa | Zakres [µg/l] | Żyjący | Zgony | OR | 95%CI | p |
I | ≤760,38 | 56 | 34 | 8,4 | 3,31-21,33 | <0,0001* |
II | 760,39-839,63 | 75 | 14 | 2,58 | 0,94-7,06 | 0,095 |
III | 839,64-931,72 | 78 | 11 | 1,95 | 0,69-5,53 | 0,31 |
IV | ≥931,73 | 83 | 6 | Ref. | Ref. | Ref. |
*wynik istotny statystycznie (p <0,05) P.437046
Wśród mężczyzn ze zdiagnozowanym rakiem prostaty, u których stężenie cynku w surowicy zawiera się w przedziale 1000-1200 zaobserwowano blisko 4-krotnie zmniejszone ryzyko zgonu, w stosunku do mężczyzn, u których stężenie cynku jest niższe niż 900 µg/l.
Częstość zgonów w zależności od stężenia cynku w surowicy u mężczyzn z rakiem prostaty ciągu 5 lat od rozpoznania (wybrane zakresy)
Grupa | Zakres [µg/l] | Żyjący | Zgony | OR | 95%CI | p |
I | <900 | 180 | 54 | 3,7 | 1,09-12,48 | 0,03* |
II | 1000-1200 | 37 | 3 | Ref. | Ref. | Ref. |
*wynik istotny statystycznie (p <0,05) P.437046
Powyższe wyniki stanowią przedmiot zgłoszenia patentowego nr P.437046
Survival of patients with laryngeal cancer
Wśród osób z rakiem krtani ponad 2-krotnie zmniejszone ryzyko zgonu miały osoby chore ze stężeniem cynku powyżej 688 µg/l w surowicy w porównaniu do osób ze stężeniem <580 µg/l.
Częstość zgonów w zależności od stężenia cynku w surowicy u pacjentów z rakiem krtani w ciągu 5 lat od rozpoznania (tercyle)
Grupa | Zakres [µg/l] | Żyjący | Zgony | OR | 95%CI | p |
I | 357,76-580,38 | 52 | 52 | 2,45 | 1,4-4,4 | <0,01* |
II | 584,46-688,89 | 67 | 37 | 1,35 | 0,8-2,4 | 0,31 |
III | 688,94-1317,87 | 76 | 31 | Ref. | Ref. | Ref. |
*wynik istotny statystycznie (p <0,05) P.427370
Powyższe wyniki stanowią przedmiot publikacji Lubiński J. et al., Survival of Laryngeal Cancer Patients Depending on Zinc Serum Level and Oxidative Stress Genotypes, Biomolecules 2021, 11, 865.[40]
Miedź pełni różne funkcje w strukturze białek oraz jako katalizator dzięki zdolności do zmian stopnia utlenienia i redukcji i występuje w stanie utlenionym (Cu2+) lub zredukowanym (Cu+). Jony miedziowe mogą uczestniczyć w szerokim spektrum interakcji z białkami, umożliwiając powstawanie złożonych struktur oraz pośrednicząc w skomplikowanych reakcjach biochemicznych.[41,42] Miedź, podobnie jak inne pierwiastki śladowe, jest z jednej strony niezbędna dla organizmu, z drugiej jednak strony jest bardzo niebezpieczna. Generalnie jednak stany, które charakteryzują się ogólnym lub komórkowo-specyficznym nagromadzeniem miedzi zdarzają się rzadko i najczęściej występują w wyniku określonych zaburzeń o podłożu genetycznym.[43]
Evaluation of the cancer risk in women - BRCA1 non-carriers
Kobiety niepalące, w wieku poniżej 50 roku życia ze stężeniem miedzi we krwi pomiędzy 850-1000 µg/l mają niemal 3-krotnie zmniejszone ryzyko zachorowania na raka.
Częstość występowania raków u kobiet niepalących poniżej 50 roku życia, u których nie stwierdzono mutacji w genie BRCA1 (wybrane zakresy).
Grupa | Zakres [µg/l] | Osoby chore | Osoby zdrowe | OR | 95%CI | p |
I | 850-1000 | 16 | 493 | Ref. | Ref. | Ref. |
II | <850 | 13 | 156 | 2,6 | 1,2-5,5 | 0,02* |
*wynik istotny statystycznie (p <0,05) P.438572
Zanieczyszczenie środowiska ołowiem stanowi nieustający problem dla rozwijających się społeczeństw. Toksyczne działanie ołowiu dotyczy głównie jego wpływu na układ krwiotwórczy[44], obwodowy i ośrodkowy układ nerwowy[45] oraz przewód pokarmowy[46]. Ze względu na wszechobecność ołowiu, praktycznie każdy człowiek narażony jest na kontakt z tym pierwiastkiem. Toksyczność ołowiu prowadzi między innymi do zmiany aktywności wielu enzymów oraz zaburzeń funkcji wolnych i strukturalnych białek w komórce[47]. Wiele badań sugeruje, że ważnym molekularnym mechanizmem toksyczności ołowiu jest jego udział w powstawaniu wolnych rodników tlenowych, które odgrywają dużą rolę w powstawaniu uszkodzeń wewnątrzkomórkowych oraz w patogenezie wielu schorzeń, w tym nowotworów złośliwych[48]. Według klasyfikacji karcynogenów IARC, ołów i jego związki należą do grupy 2a i 2b tj. potencjalnie karcinogennych[12].
Evaluation of the cancer risk in women - BRCA1 non-carriers
Kobiety, ze stężeniem ołowiu we krwi ≤ 8 µg/l, wykazują istotnie blisko 9-krotnie zmniejszone ryzyko rozwoju raka.
Częstość występowania nowotworów w zależności od stężenia ołowiu u kobiet. (wybrane zakresy).
| Grupa | Zakres [µg/l] | Osoby chore | Osoby zdrowe | OR | 95%CI | p |
| I | ≤8 | 1 | 372 | Ref. | Ref. | Ref. |
| II | >8 | 26 | 1094 | 8,84 | 1,2-65,41 | 0,006* |
*wynik istotny statystycznie (p <0,05) P.433150
Evaluation of the cancer risk in women - BRCA1 carriers
Kobiety, ze stężeniem ołowiu we krwi ≤ 8 µg/l, wykazują istotnie 3-krotnie zmniejszone ryzyko rozwoju raka.
Częstość występowania nowotworów w zależności od stężenia ołowiu u kobiet. (wybrane zakresy).
| Grupa | Zakres [µg/l] | Osoby chore | Osoby zdrowe | OR | 95%CI | p |
| I | ≤8 | 8 | 217 | Ref. | Ref. | Ref. |
| II | >8 | 87 | 812 | 2,9 | 1,4-6,1 | 0,002* |
*wynik istotny statystycznie (p <0,05) P.433150
Evaluation of the cancer risk in men
Mężczyźni poniżej 60 roku życia, niepalący wykazują blisko 8-krotnie obniżone ryzyko zachorowania, jeśli ich stężenie ołowiu jest niższe niż 13,5 µg/l.
Częstość występowania nowotworów w zależności od stężenia ołowiu u mężczyzn niepalących poniżej 60 roku życia (wybrane zakresy).
| Grupa | Zakres [µg/l] | Osoby chore | Osoby zdrowe | OR | 95%CI | p |
| I | <13,5 | 1 | 217 | Ref. | Ref. | Ref. |
| II | >13,5 | 16 | 447 | 7,8 | 1,02-59,0 | 0,017* |
*wynik istotny statystycznie (p <0,05) P.437899
Mężczyźni powyżej 60 roku życia, niepalący wykazują 4-krotnie obniżone ryzyko zachorowania na nowotwory, jeśli ich stężenie ołowiu zawiera się w przedziale 20-50 µg/l we krwi pełnej.
Częstość występowania nowotworów w zależności od stężenia ołowiu u mężczyzn niepalących powyżej 60 roku życia (wybrane zakresy).
| Grupa | Zakres [µg/l] | Osoby chore | Osoby zdrowe | OR | 95%CI | p |
| I | 20-50 | 3 | 74 | Ref. | Ref. | Ref. |
| II | <20 & >50 | 15 | 90 | 4,1 | 1,1-14,8 | 0,02* |
wynik istotny statystycznie (p <0,05) P.437899
Mangan (Mn) jest niezbędnym składnikiem odżywczym biorącym udział w prawidłowym funkcjonowaniu układu odpornościowego, regulacji poziomu cukru we krwi i energii komórkowej, rozmnażania, trawienia, wzrostu kości, krzepnięcia krwi i homeostazy oraz obrony przed reaktywnymi formami tlenu. Funkcje pełnione przez metaloproteiny manganu obejmują oksyreduktazy, transferazy, hydrolazy, liazy, izomerazy oraz ligazy. [49] Mn działa jako kofaktor dla różnych enzymów, w tym arginazy, syntetazy glutaminy (GS), karboksylazy pirogronianowej i dysmutazy ponadtlenkowej Mn (Mn-SOD) [50]. Mn ma tendencję do odkładania się w wątrobie, trzustce, kościach oraz mózgu [50].
W literaturze można znaleźć badania opisujące korelację pomiędzy stężeniem Mn w surowicy a ryzykiem raka piersi oraz jelita grubego. Opublikowane badania mają jednak charakter retrospektywny co powoduje, że nie są one wiarygodne dla stwierdzenia, że mangan jest markerem ryzyka zachorowania na raka. W naszym Ośrodku oceniliśmy korelację pomiędzy stężeniem manganu a przeżyciami kobiet z rakiem piersi.
Survival of patients with breast cancer
Kobiety ze zdiagnozowanym rakiem piersi, u których stężenie manganu w surowicy zawiera się w przedziale 1-10 µg/l, wykazują istotnie ponad 1,5 krotnie zmniejszone ryzyko zgonu w odniesieniu do pozostałych kobiet.
Częstość zgonów w zależności od stężenia manganu w surowicy u kobiet z rakiem piersi w ciągu 10 lat od rozpoznania (wybrane zakresy).
Grupa | Zakres µg/l | Żyjący | Zgony | HR | 95%CI | p |
I | 1,0-10,0 | 197 | 49 | Ref. | Ref. | Ref. |
II | <1 & > 10 | 204 | 87 | 1,55 | 1,09-2,20 | 0,01* |
*wynik istotny statystycznie (p <0,05) P.438040
Chrom (Cr) należy do pierwiastków szeroko rozpowszechnionych w skorupie ziemskiej. Pierwiastek ten w niewielkich ilościach jest niezbędny dla prawidłowego funkcjonowania organizmu pełniąc rolę w przemianach metabolicznych glukozy, niektórych białek i tłuszczów [51–53]. Zwiększone dawki chromu mogą mieć silne działanie toksyczne, wpływając destrukcyjnie na wątrobę, nerki i układ krwiotwórczy oraz powodując nowotwory [51,54,55]. Stwierdzono, że Cr(VI) wykazuje silne działanie mutagenne. Wyniki badań asocjacyjnych wskazują na związek pomiędzy stężeniem chromu we krwi oraz ryzykiem nowotworów w obrębie głowy, szyi i jamy ustnej.
W naszym Ośrodku wykonano pracę nad korelacją pomiędzy stężeniem chromu w surowicy a przeżyciem kobiet ze zdiagnozowanym rakiem piersi.
Survival of patients with breast cancer
Kobiety ze zdiagnozowanym rakiem piersi, u których stężenie chromu w surowicy zawiera się w przedziale 0,20-3,5 µg/l, wykazują istotnie blisko 2 krotnie zmniejszone ryzyko zgonu.
Częstość zgonów w zależności od stężenia chromu w surowicy u kobiet z rakiem piersi w ciągu 10 lat od rozpoznania (wybrane zakresy).
Grupa | Zakres µg/l | Żyjący | Zgony | HR | 95%CI | p |
I | 0,20-3,5 | 202 | 54 | Ref. | Ref. | Ref. |
II | <0,20 & > 3,5 | 199 | 82 | 1,8 | 1,28-2,54 | 0,0002* |
*wynik istotny statystycznie (p <0,05) P.438042
Kobiety palące papierosy, u których zdiagnozowano nowotwór złośliwy piersi, wykazują istotnie blisko 4,5 krotnie zmniejszone ryzyko zgonu, jeśli ich stężenie chromu w surowicy jest wyższe niż 0,5 µg/l.
Częstość zgonów w zależności od stężenia chromu w surowicy u kobiet palących z rakiem piersi w ciągu 10 lat od rozpoznania (wybrane zakresy).
Grupa | Zakres µg/l | Żyjący | Zgony | HR | 95%CI | p |
I | <0,5 | 157 | 56 | 4,46 | 1,39-14,26 | 0,01* |
II | ≥0,5 | 38 | 3 | Ref. | Ref. | Ref. |
*wynik istotny statystycznie (p <0,05) P.438042
Norms
Pierwiastek | Grupa | Podgrupa | Norma [µg/l] | Publikacja/ Nr zgłoszenia patentowego |
Selenium | Kobiety BRCA1 (-) | Palenie (-); < 60 r.ż. Palenie (-); > 60 r.ż. Palenie (+) | 100-110 94-104 110-120 | P.438038 |
| Kobiety BRCA1 (+) | < 50 r.ż. > 50 r.ż. | 70-80 95-120 | P.435603 |
| men | Palenie (-) Palenie (+); < 60 r.ż. Palenie (+); > 60 r.ż. | 100-110 NZ* 115-130 | P.437898 |
Arsenic | Kobiety BRCA1 (-) | – | < 0,6 | Marciniak W., 2020[13] P.425602 |
| Kobiety BRCA1 (+) | – | < 0,85 | Marciniak W., 2021[14] |
| men | – | 0,7-1,14 | P.437896 |
Cadmium | Kobiety BRCA1 (-) | Palenie (-) < 50 r.ż. Palenie (-) > 50 r.ż. Palenie (+) | NZ* 0,28-0,33 NZ* | P.437608 |
| Kobiety BRCA1 (+) | Palenie (-) Palenie (+) | < 0,27 NZ* | Derkacz R, 2021[28] PAT.237085 |
| men | Palenie (-) Palenie (+) | < 0,21 NZ* | P.437897 |
Zinc | Kobiety BRCA1 (-) | Palenie (-); < 50 r.ż. Palenie (-); > 50 r.ż. Palenie (+) | NZ* 5600-6100 NZ* | P.437571 |
| Kobiety BRCA1 (+) | Palenie (-) Palenie (+) | 6000-6700 6400-6800 | P.425603 |
| men | Palenie (-) Palenie (+) | 5700-6350 NZ* | P.437894 |
Copper | Kobiety BRCA1 (-) | < 50 r.ż. > 50 r.ż. | 850-1000 < 1000 | P.438572 |
| Kobiety BRCA1 (+) | Palenie (-);< 50 r.ż. Palenie (-); > 50 r.ż. Palenie (+) | 750-825 < 1000 < 1000 | |
| men | – | < 800 | P.437895 |
Lead | Kobiety BRCA1 (-) | – | ≤ 7,5 | P.438655 |
| Kobiety BRCA1 (+) | – | < 8 | P.433150 |
| men | Palenie (-); < 60 r.ż. Palenie (-); > 60 r.ż. Palenie (+) | < 13,5 < 50 NZ* | P.437899 |
- NZ – dotychczas nie znaleziono korelacji pomiędzy stężeniem pierwiastka a ryzykiem raków w tej podgrupie klinicznej
- Kobiety BRCA1 (-) – kobiety bez wykrytej mutacji w genie BRCA1
- Kobiety BRCA1 (+) – kobiety z wykrytą mutacją w genie BRCA1
- Palenie (-) – osoby niepalące papierosów
- Palenie (+) – osoby palące papierosy
Pierwiastek | Grupa | Norma [µg/l] | Publikacja/ Nr zgłoszenia patentowego |
Selenium | women men | 95-102,5 | Lener M, 2016[10] Lubiński JA, 2018[56] Lubiński J, 20118[57] Pietrzak S, 2019[9] Szwiec M, 2021[8] Rogoża-Janiszewska E., 2021[11] P.437046 |
Arsenic | men | 0,75-1,0 | P.437046 |
Zinc | women men | 1025-1175 | Lubiński J, 2021[40] P.434767 P.437046 |
Copper | women men | <1000 ≤ 900 | P.436999 |
Chromium | women | >0,5 | P.438042 |
Manganese | women | 1-10 | P.438040 |
- Hariharan, S.; Dharmaraj, S. Selenium and Selenoproteins: It’s Role in Regulation of Inflammation. Inflammopharmacology 2020, 28, 667–695, doi:10.1007/s10787-020-00690-x.
- Combs, G.F.; Clark, L.C.; Turnbull, B.W. An Analysis of Cancer Prevention by Selenium. Biofactors 2001, 14, 153–159, doi:10.1002/biof.5520140120.
- Reddy, V.N.; Giblin, F.J.; Lin, L.R.; Dang, L.; Unakar, N.J.; Musch, D.C.; Boyle, D.L.; Takemoto, L.J.; Ho, Y.S.; Knoernschild, T.; et al. Glutathione Peroxidase-1 Deficiency Leads to Increased Nuclear Light Scattering, Membrane Damage, and Cataract Formation in Gene-Knockout Mice. Invest Ophthalmol Vis Sci 2001, 42, 3247–3255.
- Kuria, A.; Fang, X.; Li, M.; Han, H.; He, J.; Aaseth, J.O.; Cao, Y. Does Dietary Intake of Selenium Protect against Cancer? A Systematic Review and Meta-Analysis of Population-Based Prospective Studies. Crit Rev Food Sci Nutr 2020, 60, 684–694, doi:10.1080/10408398.2018.1548427.
- Jenkins, D.J.A.; Kitts, D.; Giovannucci, E.L.; Sahye-Pudaruth, S.; Paquette, M.; Blanco Mejia, S.; Patel, D.; Kavanagh, M.; Tsirakis, T.; Kendall, C.W.C.; et al. Selenium, Antioxidants, Cardiovascular Disease, and All-Cause Mortality: A Systematic Review and Meta-Analysis of Randomized Controlled Trials. Am J Clin Nutr 2020, 112, 1642–1652, doi:10.1093/ajcn/nqaa245.
- Schomburg, L. The Other View: The Trace Element Selenium as a Micronutrient in Thyroid Disease, Diabetes, and Beyond. Hormones (Athens) 2020, 19, 15–24, doi:10.1007/s42000-019-00150-4.
- Kenfield, S.A.; Van Blarigan, E.L.; DuPre, N.; Stampfer, M.J.; L Giovannucci, E.; Chan, J.M. Selenium Supplementation and Prostate Cancer Mortality. J Natl Cancer Inst 2015, 107, 360, doi:10.1093/jnci/dju360.
- Szwiec, M.; Marciniak, W.; Derkacz, R.; Huzarski, T.; Gronwald, J.; Cybulski, C.; Dębniak, T.; Jakubowska, A.; Lener, M.; Falco, M.; et al. Serum Selenium Level Predicts 10-Year Survival after Breast Cancer. Nutrients 2021, 13, 953, doi:10.3390/nu13030953.
- Pietrzak, S.; Wójcik, J.; Scott, R.J.; Kashyap, A.; Grodzki, T.; Baszuk, P.; Bielewicz, M.; Marciniak, W.; Wójcik, N.; Dębniak, T.; et al. Influence of the Selenium Level on Overall Survival in Lung Cancer. J Trace Elem Med Biol 2019, 56, 46–51, doi:10.1016/j.jtemb.2019.07.010.
- Lener, M.R.; Scott, R.J.; Wiechowska-Kozłowska, A.; Serrano-Fernández, P.; Baszuk, P.; Jaworska-Bieniek, K.; Sukiennicki, G.; Marciniak, W.; Muszyńska, M.; Kładny, J.; et al. Serum Concentrations of Selenium and Copper in Patients Diagnosed with Pancreatic Cancer. Cancer Res Treat 2016, 48, 1056–1064, doi:10.4143/crt.2015.282.
- Rogoża-Janiszewska E. et al Serum Selenium Level and the 10-Year Survival after Melanoma. Biomedicines SI: Role of Trace Elements in Chemoprevention and Cancer Therapy 2021.
- List of Classifications – IARC Monographs on the Identification of Carcinogenic Hazards to Humans Available online: https://monographs.iarc.who.int/list-of-classifications/ (accessed on 20 July 2021).
- Marciniak, W.; Derkacz, R.; Muszyńska, M.; Baszuk, P.; Gronwald, J.; Huzarski, T.; Cybulski, C.; Jakubowska, A.; Falco, M.; Dębniak, T.; et al. Blood Arsenic Levels and the Risk of Familial Breast Cancer in Poland. Int J Cancer 2020, 146, 2721–2727, doi:10.1002/ijc.32595.
- Marciniak, W.; Matoušek, T.; Domchek, S.; Paradiso, A.; Patruno, M.; Irmejs, A.; Roderte, I.; Derkacz, R.; Baszuk, P.; Kuświk, M.; et al. Blood Arsenic Levels as a Marker of Breast Cancer Risk among BRCA1 Carriers. Cancers 2021, 13, 3345, doi:10.3390/cancers13133345.
- Fowler, B.A. Monitoring of Human Populations for Early Markers of Cadmium Toxicity: A Review. Toxicol Appl Pharmacol 2009, 238, 294–300, doi:10.1016/j.taap.2009.05.004.
- Vinceti, M.; Venturelli, M.; Sighinolfi, C.; Trerotoli, P.; Bonvicini, F.; Ferrari, A.; Bianchi, G.; Serio, G.; Bergomi, M.; Vivoli, G. Case-Control Study of Toenail Cadmium and Prostate Cancer Risk in Italy. Sci Total Environ 2007, 373, 77–81, doi:10.1016/j.scitotenv.2006.11.005.
- Qayyum, M.A.; Shah, M.H. Comparative Study of Trace Elements in Blood, Scalp Hair and Nails of Prostate Cancer Patients in Relation to Healthy Donors. Biol Trace Elem Res 2014, 162, 46–57, doi:10.1007/s12011-014-0123-4.
- Pirincci, N.; Gecit, I.; Gunes, M.; Kaba, M.; Tanik, S.; Yuksel, M.B.; Arslan, H.; Demir, H. Levels of Serum Trace Elements in Renal Cell Carcinoma Cases. Asian Pac J Cancer Prev 2013, 14, 499–502, doi:10.7314/apjcp.2013.14.1.499.
- Kellen, E.; Zeegers, M.P.; Hond, E.D.; Buntinx, F. Blood Cadmium May Be Associated with Bladder Carcinogenesis: The Belgian Case-Control Study on Bladder Cancer. Cancer Detect Prev 2007, 31, 77–82, doi:10.1016/j.cdp.2006.12.001.
- Wolf, C.; Strenziok, R.; Kyriakopoulos, A. Elevated Metallothionein-Bound Cadmium Concentrations in Urine from Bladder Carcinoma Patients, Investigated by Size Exclusion Chromatography-Inductively Coupled Plasma Mass Spectrometry. Anal Chim Acta 2009, 631, 218–222, doi:10.1016/j.aca.2008.10.035.
- Farzin, L.; Moassesi, M.E.; Sajadi, F.; Ahmadi Faghih, M.A. Evaluation of Trace Elements in Pancreatic Cancer Patients in Iran. Middle East Journal of Cancer 2013, 4, 79–86.
- Amaral, A.F.S.; Porta, M.; Silverman, D.T.; Milne, R.L.; Kogevinas, M.; Rothman, N.; Cantor, K.P.; Jackson, B.P.; Pumarega, J.A.; López, T.; et al. Pancreatic Cancer Risk and Levels of Trace Elements. Gut 2012, 61, 1583–1588, doi:10.1136/gutjnl-2011-301086.
- Wu, H.-D.I.; Chou, S.-Y.; Chen, D.-R.; Kuo, H.-W. Differentiation of Serum Levels of Trace Elements in Normal and Malignant Breast Patients. Biol Trace Elem Res 2006, 113, 9–18, doi:10.1385/BTER:113:1:19.
- Deeb, M.; El-Sheredy, H.; Mohammed, A. The Role of Serum Trace Elements and Oxidative Stress in Egyptian Breast Cancer Patients. Advances in Breast Cancer Research 2016, 05, 37–47, doi:10.4236/abcr.2016.51004.
- Sabir, S.; Akash, M.S.H.; Fiayyaz, F.; Saleem, U.; Mehmood, M.H.; Rehman, K. Role of Cadmium and Arsenic as Endocrine Disruptors in the Metabolism of Carbohydrates: Inserting the Association into Perspectives. Biomed Pharmacother 2019, 114, 108802, doi:10.1016/j.biopha.2019.108802.
- Lee, J.-E.; Kim, H.-R.; Lee, M.; Kim, N.-H.; Wang, K.-M.; Lee, S.; Park, O.; Hong, E.-J.; Youn, J.-W.; Kim, Y.-Y. Smoking-Related DNA Methylation Is Differentially Associated with Cadmium Concentration in Blood. Biochem Genet 2020, 58, 617–630, doi:10.1007/s10528-020-09965-y.
- Bolam, T.; Bersuder, P.; Burden, R.; Shears, G.; Morris, S.; Warford, L.; Thomas, B.; Nelson, P. Cadmium Levels in Food Containing Crab Brown Meat: A Brief Survey from UK Retailers. Journal of Food Composition and Analysis 2016, 54, 63–69, doi:10.1016/j.jfca.2016.10.005.
- Derkacz R. et al. Blood Cadmium Level and the Risk of Cancer in Women with BRCA1 Mutations. Cancers, SI: Advances in Inherited Breast and Ovarian Cancer and Its Imaging 2021.
- Nasiadek, M.; Stragierowicz, J.; Klimczak, M.; Kilanowicz, A. The Role of Zinc in Selected Female Reproductive System Disorders. Nutrients 2020, 12, 2464, doi:10.3390/nu12082464.
- Puzanowska-Tarasiewicz, H.; Kuźmicka, L.; Tarasiewicz, M. Funkcje biologiczne wybranych pierwiastków i ich związków. 3, 3,. Polski Merkuriusz Lekarski : organ Polskiego Towarzystwa Lekarskiego. 2009, 419–422.
- To, P.K.; Do, M.H.; Cho, J.-H.; Jung, C. Growth Modulatory Role of Zinc in Prostate Cancer and Application to Cancer Therapeutics. Int J Mol Sci 2020, 21, E2991, doi:10.3390/ijms21082991.
- Zaichick VYe, null; Sviridova, T.V.; Zaichick, S.V. Zinc in the Human Prostate Gland: Normal, Hyperplastic and Cancerous. Int Urol Nephrol 1997, 29, 565–574, doi:10.1007/BF02552202.
- Siddiqui, M.K.J.; Jyoti, null; Singh, S.; Mehrotra, P.K.; Singh, K.; Sarangi, R. Comparison of Some Trace Elements Concentration in Blood, Tumor Free Breast and Tumor Tissues of Women with Benign and Malignant Breast Lesions: An Indian Study. Environ Int 2006, 32, 630–637, doi:10.1016/j.envint.2006.02.002.
- Pasha, Q.; Malik, S.A.; Shah, M.H. Statistical Analysis of Trace Metals in the Plasma of Cancer Patients versus Controls. J Hazard Mater 2008, 153, 1215–1221, doi:10.1016/j.jhazmat.2007.09.115.
- el-Ahmady, O.; el-Maraghy, A.; Ibrahim, A.; Ramzy, S. Serum Copper, Zinc, and Iron in Patients with Malignant and Benign Pulmonary Diseases. Nutrition 1995, 11, 498–501.
- Kuo, H.W.; Chen, S.F.; Wu, C.C.; Chen, D.R.; Lee, J.H. Serum and Tissue Trace Elements in Patients with Breast Cancer in Taiwan. Biol Trace Elem Res 2002, 89, 1–11, doi:10.1385/BTER:89:1:1.
- Zhou, W.; Park, S.; Liu, G.; Miller, D.P.; Wang, L.I.; Pothier, L.; Wain, J.C.; Lynch, T.J.; Giovannucci, E.; Christiani, D.C. Dietary Iron, Zinc, and Calcium and the Risk of Lung Cancer. Epidemiology 2005, 16, 772–779, doi:10.1097/01.ede.0000181311.11585.59.
- Zhang, X.; Giovannucci, E.L.; Smith-Warner, S.A.; Wu, K.; Fuchs, C.S.; Pollak, M.; Willett, W.C.; Ma, J. A Prospective Study of Intakes of Zinc and Heme Iron and Colorectal Cancer Risk in Men and Women. Cancer Causes Control 2011, 22, 1627–1637, doi:10.1007/s10552-011-9839-z.
- Leitzmann, M.F.; Stampfer, M.J.; Wu, K.; Colditz, G.A.; Willett, W.C.; Giovannucci, E.L. Zinc Supplement Use and Risk of Prostate Cancer. J Natl Cancer Inst 2003, 95, 1004–1007, doi:10.1093/jnci/95.13.1004.
- Lubiński, J.; Jaworowska, E.; Derkacz, R.; Marciniak, W.; Białkowska, K.; Baszuk, P.; Scott, R.J.; Lubiński, J.A. Survival of Laryngeal Cancer Patients Depending on Zinc Serum Level and Oxidative Stress Genotypes. Biomolecules 2021, 11, 865, doi:10.3390/biom11060865.
- Festa, R.A.; Thiele, D.J. Copper: An Essential Metal in Biology. Curr Biol 2011, 21, R877-883, doi:10.1016/j.cub.2011.09.040.
- Ceramella, J.; Mariconda, A.; Iacopetta, D.; Saturnino, C.; Barbarossa, A.; Caruso, A.; Rosano, C.; Sinicropi, M.S.; Longo, P. From Coins to Cancer Therapy: Gold, Silver and Copper Complexes Targeting Human Topoisomerases. Bioorg Med Chem Lett 2020, 30, 126905, doi:10.1016/j.bmcl.2019.126905.
- Linder, M.C. The Relationship of Copper to DNA Damage and Damage Prevention in Humans. Mutat Res 2012, 733, 83–91, doi:10.1016/j.mrfmmm.2012.03.010.
- Johnson, F.M. The Genetic Effects of Environmental Lead. Mutat Res 1998, 410, 123–140, doi:10.1016/s1383-5742(97)00032-x.
- Marchetti, C. Molecular Targets of Lead in Brain Neurotoxicity. Neurotox Res 2003, 5, 221–236, doi:10.1007/BF03033142.
- Tomczyk, J.; Lewczuk, E.; Abdrzejak, R. Ostre Zatrucia Organicznymi Związkammi Ołowiu.; Medycyna Pracy, 1999; Vol. 50;.
- Cellular Mechanisms of Lead Neurotoxicity – PubMed Available online: https://pubmed.ncbi.nlm.nih.gov/16501435/ (accessed on 20 July 2021).
- Nersesyan, A.; Kundi, M.; Waldherr, M.; Setayesh, T.; Mišík, M.; Wultsch, G.; Filipic, M.; Mazzaron Barcelos, G.R.; Knasmueller, S. Results of Micronucleus Assays with Individuals Who Are Occupationally and Environmentally Exposed to Mercury, Lead and Cadmium. Mutat Res 2016, 770, 119–139, doi:10.1016/j.mrrev.2016.04.002.
- Aschner, M.; Erikson, K. Manganese. Adv Nutr 2017, 8, 520–521, doi:10.3945/an.117.015305.
- Chen, P. Manganese Metabolism in Humans. Front Biosci 2018, 23, 1655–1679, doi:10.2741/4665.
- Bagchi, D.; Stohs, S.J.; Downs, B.W.; Bagchi, M.; Preuss, H.G. Cytotoxicity and Oxidative Mechanisms of Different Forms of Chromium. Toxicology 2002, 180, 5–22, doi:10.1016/s0300-483x(02)00378-5.
- Cefalu, W.T.; Hu, F.B. Role of Chromium in Human Health and in Diabetes. Diabetes Care 2004, 27, 2741–2751, doi:10.2337/diacare.27.11.2741.
- Vincent, J.B. The Biochemistry of Chromium. J Nutr 2000, 130, 715–718, doi:10.1093/jn/130.4.715.
- Anderson, R.A. Chromium Metabolism and Its Role in Disease Processes in Man. Clin Physiol Biochem 1986, 4, 31–41.
- Anderson, R.A. Chromium as an Essential Nutrient for Humans. Regul Toxicol Pharmacol 1997, 26, S35-41, doi:10.1006/rtph.1997.1136.
- Lubinski, J.; Marciniak, W.; Muszynska, M.; Huzarski, T.; Gronwald, J.; Cybulski, C.; Jakubowska, A.; Debniak, T.; Falco, M.; Kladny, J.; et al. Serum Selenium Levels Predict Survival after Breast Cancer. Breast Cancer Res Treat 2018, 167, 591–598, doi:10.1007/s10549-017-4525-9.
- Lubiński, J.; Marciniak, W.; Muszynska, M.; Jaworowska, E.; Sulikowski, M.; Jakubowska, A.; Kaczmarek, K.; Sukiennicki, G.; Falco, M.; Baszuk, P.; et al. Serum Selenium Levels and the Risk of Progression of Laryngeal Cancer. PLoS One 2018, 13, e0184873, doi:10.1371/journal.pone.0184873.
