Home » Działalność naukowa
Działalność naukowa
Projekty badawcze
„Prewencja dziedzicznego raka piersi poprzez spersonalizowaną optymalizację stężeń Se, Zn, Fe w organizmie za pomocą suplementów diety”
Umowa nr INNOMED/I/16/NCBR/2014
Czas trwania projektu zgodnie z umową: 01.10.2014-30.09.2019. Projekt współfinansowany przez Unię Europejską w ramach Europejskiego Funduszu Rozwoju Regionalnego.
Partnerem projektu jest Zachodniopomorski Uniwersytet Technologiczny w Szczecinie.
Charakterystyka grup badanych
Grupy badane, których analizy są podstawą poniżej opisanych wyników, zostały utworzone spośród osób, które zostały zarejestrowane w latach 2009-2020 w Ośrodku Nowotworów Dziedzicznych w Szczecinie. Każdy pacjent podpisywał świadomą zgodę na przechowywanie i wykorzystywanie materiału biologicznego w celach naukowych. Próbki krwi i surowicy pobierano w godzinach 8-14, a pacjenci byli na czczo przez co najmniej 4 godziny przed pobraniem. Dla większości pacjentów próbka była pobrana tylko raz, ale w niektórych przypadkach również więcej razy przy okazji kolejnych wizyt. Materiał biologiczny przechowywano w -80° C do momentu oznaczenia stężenia pierwiastków. Każdy z uczestników badania wypełnił ankietę o stanie zdrowia oraz stylu życia.
Do kohorty prospektywnej włączono 2962 zdrowych (bez zdiagnozowanego nowotworu złośliwego) kobiet. W trakcie 42 miesięcznej obserwacji u 148 kobiet zdiagnozowano nowotwór złośliwy.
Charakterystykę grupy przedstawiono w poniższej tabeli.
| Chore (n=148) | Zdrowe (n=2814) | |
| Średnia wieku (zakres) | 56,46 (35-82) | 53 (33-84) |
Palenie papierosów -obecnie -w przeszłości -nigdy | 40 (27,03%) 34 (22,97%) 74 (50 %) | 605 (21,50%) 750 (26,65%) 1459 (51,84%) |
Hormony -nie -tak -brak danych | 93 (62,84%) 54 (36,49%) 1 (0,67%) | 1467 (52,13%) 1316 (46,77%) 31 (1,1%) |
Adnexektomia -nie -tak -brak danych | 135 (91,22%) 9 (6,08%) 4 (2,7%) | 2631 (93,50%) 175 (6,22%) 8 (0,28%) |
Lokalizacje nowotworów złośliwych -pierś -trzon macicy -jelito grube -czerniak -tarczyca -jajnik -szyjka macicy -chłoniak -pęcherz moczowy -płuca -nerka -żołądek -białaczka -szpiczak -glejak -trzustka |
76 (51,4%) 12 (8,1%) 10 (6,8%) 7 (4,7%) 7 (7,73%) 6 (4,05%) 5 (3,38%) 5 (3,38%) 4 (2,7%) 4 (2,7%) 3 (2,03%) 3 (2,03%) 2 (1,35%) 2 (1,35%) 1 (0,68%) 1 (0,68%) |
– – – – – – – – – – – – – – – – |
| Chore (n=107) | Zdrowe (n=1217) | |
| Średnia wieku (zakres) | 44,25 (26-66) | 40,5 (25-69) |
| Palenie papierosów
-obecnie -w przeszłości -nigdy -brak danych |
24 (22,43%) 27 (25,23%) 55 (51,4%) 1 (0,93%) |
254 (20,87%) 249 (20,46%) 699 (57,44%) 15 (1,23%) |
| Hormony
-nie -tak -brak danych |
46 (43%) 60 (56,07%) 1 (0,93%) |
603 (49,55%) 592 (48,64%) 22 (1,81%) |
| Adnexektomia
-nie -tak -brak danych |
52 (48,6%) 55 (51,4%) 0 |
688 (56,53%) 510 (41,92%) 19 (1,56%) |
| Lokalizacje nowotworów złośliwych
-pierś -jajnik -szyjka macicy -otrzewna -żołądek -jelito grube -białaczka -trzustka -skóra -krtań -tarczyca -pęcherz moczowy |
80 (74,8%) 15 (14%) 3 (2,8%) 1 (0,9%) 1 (0,9%) 1 (0,9%) 1 (0,9%) 1 (0,9%) 1 (0,9%) 1 (0,9%) 1 (0,9%) 1 (0,9%) |
– – – – – – – – – – – – |
| Chorzy (n=144) | Zdrowi (n=2812) | |
| Średnia wieku (zakres) | 60,5 (36-76) | 52 (31-87) |
| Palenie papierosów
-obecnie -w przeszłości -nigdy |
42 (29,17%) 55 (38,19%) 47 (32,64 %) |
829 (29,48%) 975 (34,67%) 1008 (35,85%) |
| Lokalizacja nowotworu złośliwego
– prostata – skóra – nerka – jelito – pęcherz moczowy – krew – płuca – wątroba – tarczyca – trzustka – żołądek – pierś – przełyk – przysadka – ślinianki – jądra |
58 (40,28%) 16 (11,11%) 13 (9,03%) 13 (9,03%) 12 (8,33%) 9 (6,25%) 6 (4,17%) 4 (2,78%) 4 (2,78%) 2 (1,39%) 2 (1,39%) 1 (0,69%) 1 (0,69%) 1 (0,69%) 1 (0,69%) 1 (0,69%) |
– – – – – – – – – – – – – – – – |
| Żyjący (n=417) | Zgony (n=121) | |
| Średnia wieku (zakres) | 55,87 (25-85) | 61,07 (28-91) |
| Palenie papierosów
-obecnie -w przeszłości -nigdy -brak danych |
89 (21,3%) 112 (26,9%) 206 (49,4%) 10 (2,4%) |
26 (21,5%) 27 (22,3%) 65 (53,7%) 3 (2,5%) |
| Receptor estrogenowy
-dodatni -ujemny -brak danych |
287 (68,8%) 114 (27,3%) 16 (3,8%) |
79 (65,3%) 32 (26,4%) 10 (8,26%) |
| Mutacja w genie BRCA1 | 50 (12%) | 11 (9,1%) |
| Chemioterapia
-tak -nie -brak danych |
211 (50,6%) 174 (41,7%) 32 (7,7%) |
65 (53,7%) 36 (29,8%) 20 (16,5%) |
| Radioterapia
-tak -nie -brak danych |
244 (58,5%) 122 (29,3%) 51 (12,2%) |
56 (46,3%) 35 (28,9%) 30 (24,8%) |
| Tamoxifen
-tak -nie -brak danych |
282 (67,6%) 122 (29,3%) 13 (3,1%) |
79 (65,3%) 33 (27,3%) 9 (7,4%) |
| Rodzaj operacji
-mastektomia -lumpektomia -brak danych |
261 (62,6%) 131 (31,4%) 25 (6%) |
82 (67,8%) 17 (14%) 22 (18,2%) |
Do badania włączono 357 pacjentów ze zdiagnozowanym i potwierdzonym histopatologicznie rakiem prostaty. Krew została zebrana w latach 2009-2015 w momencie diagnozy raka prostaty przed rozpoczęciem leczenia. Średni okres obserwacji dla pacjentów wyniósł 5 lat.
| Gleason | Żyjący (n=293) | Zgony (n=102) |
6 7 8 9 10 Brak danych | 85 (29%) 164 (56%) 20 (6,8%) 17 (5,8%) 2 (0,7%) 5 (1,7%) | 39 (38,2%) 35 (34,3%) 9 (8,8%) 11 (10,8%) 7 (6,9%) 2 (1,96%) |
| Stopień zaawansowania klinicznego 1-2 3 4 brak danych | 7 (2,7%) 232 (79,2%) 51 (17,4%) 2 (0,7%) | 4 (3,9%) 45 (44,1%) 53 (52%) – |
| Radioterpia -tak -nie | 84 (28,7%) 209 (71,3%) | 24 (23,5%) 78 (76,5%) |
| Chemioterpia -tak -nie | 3 (1%) 290 (99%) | 4 (3,9%) 98 (96,1%) |
| Hormonoterpia -tak -nie | 59 (20,1%) 234 (79,9%) | 40 (39,2%) 62 (60,8%) |
| Prostatektomia -tak -nie | 233 (79,5%) 60 (20,5%) | 33 (32,4%) 69 (67,6%) |
| Orchidektomia -tak -nie | 8 (2,7%) 285 (97,3%) | 11 (10,8%) 91 (89,2%) |
| n=315 | % | |
| Wiek zachorowania (średnia, zakres) | 61,1 (41-86) | |
| Płeć
-kobieta -mężczyzna |
49 266 |
15,6 84,4 |
| Stopień zaawansowania klinicznego
1 2 3 4 |
72 42 70 131 |
22,8 13,3 22,2 41,6 |
| Paczkolata (średnia, zakres) | 37,11 (0-150) | |
| Leczenie
-radioterapia -chemioterpia |
142 32 |
45,1 10,1 |
| % | ||
| Płeć
Mężczyźni Kobiety |
196 106 |
64,9 35,1 |
| Wiek, średnia (zakres) | 64,2 (43-86) | – |
| Paczkolata, średnia (zakres) | 33,2 (0-232,8) | – |
| Palenie papierosów
Tak Nie |
283 19 |
93,7 6,3 |
| Stopień zaawansowania klinicznego
1 2 3 4 |
129 75 79 19 |
42,7 24,8 26,2 6,3 |
| Radioterapia
Tak Nie |
78 224 |
25,8 74,2 |
| Chemioterapia
Tak Nie |
105 197 |
34,8 65,2 |
| Histologia
Gruczolakorak Rak płaskonabłonkowy Rak z dużych komórek Rak mieszany z dużych i małych komórek Rak drobnokomórkowy Inne |
136 124 21 5 3 13 |
45 41,1 7 1,7 1 4,3 |
| Osoby chore | |
| Rok urodzenia (zakres) | 1930-1976 |
| Wiek w momencie pobrania, średnia (zakres) | 63,4 (35-84) |
| Płeć
Mężczyzna Kobieta |
59 41 |
| Krewni pierwszego stopnia
Z rakiem trzustki Z rakiem o innej lokalizacji |
4 43 |
| Palenie
Tak Nie |
27 73 |
| Paczkolata, średnia (zakres) | 28,99 (2-50) |
| Żyjący (n=344) | Zgony (n=31) | |
| Wiek (średnia, zakres) | 54,6 (21-90) | 64,3 (38-86) |
| Płeć
-kobieta -mężczyzna |
218 (63%) 126 (37%) |
14 (45%) 17 (55%) |
| Stopień zaawansowania klinicznego
2 3 4-5 |
70 (20%) 145 (42%) 129 (38%) |
1 (3,2%) 12 (39%) 18 (58%) |
Wyniki badań
W organizmie selen działa poprzez białka, do których jest wbudowany w postaci selenocysteiny. Jako składnik selenobiałek selen odgrywa rolę enzymatyczną, jak i strukturalną[1]. Do jednych z ważniejszych funkcji selenobiałek należy udział w produkcji hormonów tarczycy, pobudzanie układu immunologicznego, oraz ochrona przed stresem oksydacyjnym.[2]
Zarówno niedobór jak i nadmiar tego pierwiastka może mieć niekorzystny wpływ na organizm. Prowadzi to do m.in. do zaburzeń pracy serca, zwyrodnienia serca i wątroby, zwiększenia ryzyka choroby nadciśnieniowej, ograniczenia sprawności układu odpornościowego, zaburzenia funkcji tarczycy, zaburzenia mineralizacji kości i prawidłowego wykształcenia zębów oraz zwiększenia ryzyka chorób nowotworowych. [3–7]
Ocena ryzyka wystąpienia nowotworów złośliwych u kobiet bez wykrytej mutacji w genie BRCA1
Kobiety powyżej 60 roku życia, niepalące mają istotnie 4,5 krotnie obniżone ryzyko, jeśli mają stężenie we krwi zawierające się w przedziale 94-104 µg/l. Natomiast kobiety powyżej 60 roku życia, które palą obecnie bądź paliły w przeszłości mają istotnie 3,5 krotnie obniżone ryzyko zachorowania na raka, jeśli mają stężenie selenu we krwi > 110 µg/l.
Częstość występowania raków u kobiet niepalących, powyżej 60 roku życia (wybrane zakresy).
| Grupa | Zakres [µg/l] | Osoby chore | Osoby zdrowe | OR | 95%CI | p |
| I | 94-104 | 3 | 114 | Ref. | Ref. | Ref. |
| II | <94 | 11 | 93 | 4,5 | 1,2-16,6 | 0,02* |
*wynik istotny statystycznie (p <0,05) P.438038
Częstość występowania raków u kobiet palących, powyżej 60 roku życia (wybrane zakresy).
| Grupa | Zakres [µg/l] | Osoby chore | Osoby zdrowe | OR | 95%CI | p |
| I | >110 | 4 | 97 | Ref. | Ref. | Ref. |
| II | <110 | 25 | 171 | 3,5 | 1,2-10,5 | 0,02* |
*wynik istotny statystycznie (p <0,05) P.438038
Ocena ryzyka wystąpienia nowotworów złośliwych u kobiet z wykrytą mutacją w genie BRCA1
Kobiety, poniżej 50 roku życia, ze stężeniem selenu we krwi zawierającym się w przedziale 70-80 µg/l, mają tendencję do blisko 5 krotnie obniżonego ryzyka raka w porównaniu do kobiet ze stężeniami selenu poza przedstawionym przedziałem.
Częstość występowania raków w zależności od stężenia selenu we krwi wśród kobiet poniżej 50 roku życia (wybrane zakresy).
| Grupa | Zakres [µg/l] | Osoby chore | Osoby zdrowe | OR | 95%CI | p |
| I | 70-80 | 1 | 56 | Ref. | Ref. | Ref. |
| II | <70 & >80 | 75 | 904 | 4,6 | 0,6-34,1 | 0,1* |
*wynik nieistotny statystycznie (p >0,05) P.435603
Kobiety, powyżej 50 roku życia, ze stężeniem selenu we krwi zawierającym się w przedziale 95-120 µg/l wykazują ponad 2 krotnie obniżone ryzyko zachorowania na raka w porównaniu do kobiet ze stężeniami selenu poza przedstawionym przedziałem.
Częstość występowania raków w zależności od stężenia selenu we krwi wśród kobiet powyżej 50 roku życia (wybrane zakresy).
| Grupa | Zakres [µg/l] | Osoby chore | Osoby zdrowe | OR | 95%CI | p |
| I | 95-120 | 13 | 156 | Ref. | Ref. | Ref. |
| II | <95 & >120 | 20 | 102 | 2,3 | 1,1-4,9 | 0,03* |
*wynik istotny statystycznie (p <0,05) P.435603
Ocena ryzyka wystąpienia nowotworów złośliwych u mężczyzn
Mężczyźni niepalący papierosów, ze stężeniem selenu we krwi zawierającym się w przedziale 100-110 µg/l wykazują blisko 4 krotnie obniżone ryzyko zachorowania na raka w porównaniu do mężczyzn ze stężeniami selenu poza tym przedziałem.
Częstość występowania raków w zależności od stężenia selenu we krwi wśród mężczyzn niepalących (wybrane zakresy).
| Grupa | Zakres [µg/l] | Osoby chore | Osoby zdrowe | OR | 95%CI | p |
| I | 100-110 | 5 | 260 | Ref. | Ref. | Ref. |
| II | <95 | 20 | 291 | 3,6 | 1,3-9,7 | 0,008* |
*wynik istotny statystycznie (p <0,05) P.437898 Natomiast mężczyźni powyżej 60 roku życia oraz palący papierosy w przeszłości bądź obecnie wykazują blisko 11 krotnie zmniejszone ryzyko zachorowania na nowotwór złośliwy, w przypadku występowania stężenia selenu we krwi >115 µg/l, w porównaniu do mężczyzn ze stężeniem selenu we krwi <115 µg/l.
Częstość występowania raków w zależności od stężenia selenu we krwi wśród mężczyzn palących powyżej 60 roku życia (wybrane zakresy).
| Grupa | Zakres [µg/l] | Osoby chore | Osoby zdrowe | OR | 95%CI | p |
| I | <115 | 1 | 83 | Ref. | Ref. | Ref. |
| II | ≥115 | 56 | 427 | 10,9 | 1,5-79,8 | 0,0013* |
*wynik istotny statystycznie (p <0,05) P.437898
Poniżej przedstawiono krzywą Kaplana-Meier’a dla powyższej korelacji.
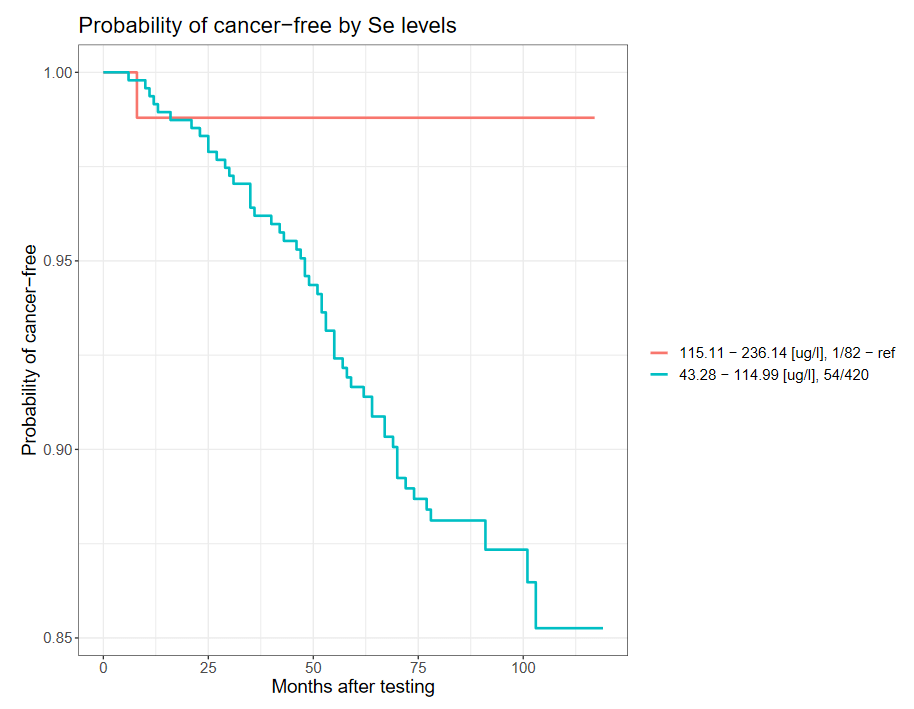
Probability of cancer-free – prawdopodobieństwo niezachorowania na raka
Months after testing – czas obserwacji w miesiącach
Przeżycia chorych z rakiem piersi
Kobiety z rakiem piersi mają istotnie większą szansę na 10-letnie przeżycie, jeśli ich stężenie selenu w surowicy wynosi >94,7 µg/l. Kobiety ze stężeniem selenu w surowicy < 70 µg/l mają ponad 25-krotnie zwiększone ryzyko zgonu w porównaniu z podgrupą o stężeniu selenu w surowicy 95-102,5 µg/l.
Częstość zgonów w zależności od stężenia selenu w surowicy u kobiet z rakiem piersi w ciągu 10 lat od rozpoznania (ćwiartki).
| Ćwiartki | Zakres [µg/l] | Żyjący | Zgony | HR | 95%CI | p |
| I | 52,1-76,7 | 89 | 46 | 2,35 | 1,12-4,55 | 0,01* |
| II | 76,8-85,1 | 105 | 29 | 1,52 | 0,76-3,02 | 0,23 |
| III | 85,2-94,6 | 105 | 29 | 1,95 | 1,01-3,76 | 0,047* |
| IV | 94,7-171,5 | 118 | 17 | Ref. | Ref. | Ref. |
*wynik istotny statystycznie (p <0,05)
Częstość zgonów w zależności od stężenia selenu w surowicy u kobiet z rakiem piersi w ciągu 10 lat od rozpoznania (zakresy).
| Ćwiartki | Zakres [µg/l] | Żyjący | Zgony | OR | 95%CI | p |
| I | < 70 | 32 | 28 | Ref. | Ref. | Ref. |
| II | 95-102,5 | 62 | 2 | 27,1 | 6,7-121,2 | <0,0001* |
*wynik istotny statystycznie (p <0,05)
Powyższe wyniki stanowią część publikacji Szwiec M et al., Serum Selenium Level Predicts 10-Years Survival after Breast Cancer; Nutrients 2021, 13(3), 953. [8]
Przeżycia chorych z rakiem prostaty
Mężczyźni z rakiem prostaty oraz stężeniem selenu w surowicy w zakresie 85-105 µg/l wykazują istotnie ponad 8 krotnie zmniejszone ryzyko zgonu w stosunku do podgrupy ze stężeniem selenu w surowicy poniżej 70 µg/l.
Częstość zgonów w zależności od stężenia selenu w surowicy u mężczyzn z rakiem prostaty w ciągu 5 lat od rozpoznania (wybrane zakresy).
| Grupa | Zakres [µg/l] | Żyjący | Zgony | OR | 95%CI | p |
| I | ≤70 | 61 | 33 | 8,6 | 3,4-21,7 | <0,0001* |
| II | 85-105 | 95 | 6 | Ref. | Ref. | Ref. |
*wynik istotny statystycznie (p <0,05) P.437046
Przeżycia chorych z rakiem płuca
Zaobserwowano, że większe szanse na dłuższe przeżycie po diagnozie raka płuca maja osoby, u których stężenie selenu w surowicy wynosi >67,4 µg/l w porównaniu do osób o niskim stężeniu tego pierwiastka w surowicy (<55,1 µg/l).
Częstość zgonów w zależności od stężenia selenu w surowicy u pacjentów z rakiem płuca w I stopniu zaawansowania w ciągu 3 lat od rozpoznania (tertyle).
| Tertyle | Zakres [µg/l] | Ilość osób | OR | 95%CI | p |
| I | 33,46-57,91 | 43 | 2,73 | 1,21-6,11 | 0,01* |
| II | 57,92-68,86 | 42 | 1,88 | 0,83-4,28 | 0,13 |
| III | 69,29-108,27 | 44 | Ref. | Ref. | Ref. |
*wynik istotny statystycznie (p <0,05)
Powyższe wyniki stanowią część publikacji Pietrzak S. et al., Influence of the selenium level on overall survival in lung cancer, Journal of Trace Elements in Medicine and Biology 2019, 56:46-51.[9]
Przeżycia chorych z rakiem trzustki
Pacjenci ze zdiagnozowanym rakiem trzustki mają 3-krotnie większą szansę na 6-miesięczne przeżycie, jeśli ich stężenie selenu w surowicy jest ≥ 63,67 µg/l w porównaniu do pacjentów ze stężeniem selenu poniżej tej wartości.
Częstość zgonów w zależności od stężenia selenu w surowicy u pacjentów z rakiem trzustki w ciągu 6 miesięcy od rozpoznania (wybrane zakresy).
| Grupa | Zakres [µg/l] | Żyjący | Zgony | OR | 95%CI | p |
| I | >< 63,67 | 24 | 33 | 0,4 | 0,1-0,97 | 0,03* |
| II | ≥ 63,67 | 22 | 11 | Ref. | Ref. | Ref. |
Powyższe wyniki stanowią część publikacji Lener M. et al., Serum concentration of Selenium and Copper in Patients Diagnosed with Pancreatic Cancer, Cancer Res Treat., 2016, 48(3):1056-1064.[10]
Przeżycia chorych z czerniakiem złośliwym
Pacjenci ze zdiagnozowanym czerniakiem złośliwym mają istotnie większą szansę na 10-lecie przeżycie, jeśli ich stężenie selenu w surowicy jest wyższe niż 96 µg/l. Pacjenci ze stężeniem selenu w surowicy < 76 µg/l mają blisko 6-krotnie zwiększone ryzyko zgonu w porównaniu z podgrupą o stężeniu selenu w surowicy > 96 µg/l.
Częstość zgonów w zależności od stężenia selenu w surowicy u pacjentów z czerniakiem złośliwym w ciągu 10 lat od rozpoznania (ćwiartki).
| Ćwiartki | Zakres [µg/l] | Żyjący | Zgony | HR | 95%CI | p |
| I | 56,7-76,2 | 78 | 16 | 5,83 | 1,32-25,8 | 0,02* |
| II | 76,4-85,01 | 86 | 7 | 3,37 | 0,7-16,3 | 0,13 |
| III | 85,15-96,06 | 88 | 6 | 3,34 | 0,67-16,7 | 0,14 |
| IV | 96,15-168 | 92 | 2 | Ref. | Ref. | Ref. |
*wynik istotny statystycznie (p<0,05) P.438563
Powyższe wyniki stanowią przedmiot publikacji Rogoża-Janiszewska E. et al., Serum selenium level and the 10-year survival after melanoma, Biomedicines, 2021.[11]
Arsen i jego związki są jednymi z najbardziej rozpoznawalnych trucizn. Według klasyfikacji międzynarodowej agencji do badań nad rakiem (IARC, ang. International Agency for Cancer Research) arsen i jego związki zostały określone jako bezwzględne ludzkie karcynogeny – grupa 1.[12] Różnorodność objawów klinicznych wywołanych inhalacją związkami arsenu lub jego spożyciem jest bardzo duża. W zależności od stężenia, czasu ekspozycji i drogi zaabsorbowania skutki oddziaływania arsenu z tkankami są od stosunkowo niegroźnych na przykład hipopigmentacji, po zagrażające życiu nowotwory (WHO). W świetle istniejących danych literaturowych można stwierdzić, że nie tylko wysokie, ale i nieznacznie podwyższone stężenia arsenu mogą być przyczyną raków, zwłaszcza u kobiet.
Ocena ryzyka wystąpienia nowotworów złośliwych u kobiet bez wykrytej mutacji w genie BRCA1
Kobiety ze stężeniem arsenu we krwi poniżej 0,6 µg/l wykazują istotne blisko 5-krotnie obniżone ryzyko rozwoju raków zwłaszcza raków piersi w porównaniu do kobiet ze stężeniem arsenu powyżej 0,6 µg/l (OR=4,7; p=0,0004; 95%CI:1,9-11,7).
Częstość występowania raków piersi w zależności od stężenia arsenu we krwi (wybrane zakresy)
| Grupa | Zakres stężeń µg/l | Osoby chore | Osoby zdrowe | OR | 95%CI | p |
| I | <0,6 | 5 | 735 | Ref. | Ref. | Ref. |
| II | 0,6-0,81 | 18 | 723 | 3,7 | 1,4-10 | 0,01* |
| III | 0,82-1,25 | 21 | 719 | 4,3 | 1,6-11-5 | 0,002* |
| IV | >1,25 | 32 | 709 | 6,6 | 2,6-17,1 | <0,0001* |
| Wybrane zakresy | ||||||
| I | <0,6 | 5 | 735 | Ref. | Ref. | Ref. |
| II | ≥0,6 | 71 | 2222 | 4,7 | 1,9-11,7 | 0,0004* |
*wynik istotny statystycznie (p <0,05) P.425602
Poniżej przedstawiono krzywą dla powyższej korelacji.
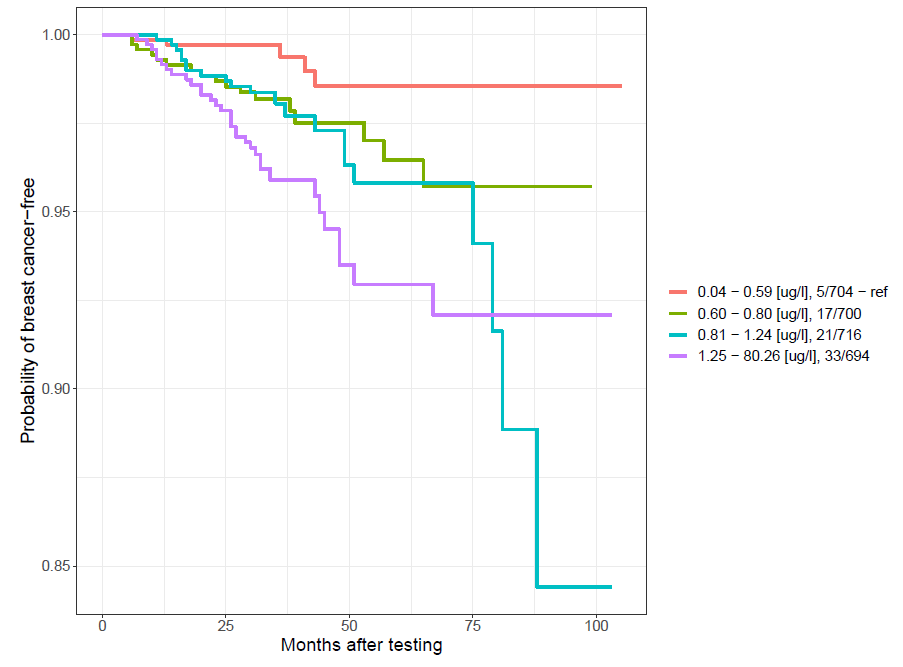
Probability of cancer-free – prawdopodobieństwo niezachorowania na raka/ Months after testing – czas obserwacji w miesiącach
Powyższe wyniki stanowią przedmiot publikacji Marciniak W. et al., Blood arsenic levels and the risk of familial breast cancer in Poland, Int J Cancer, 2020, 146 (10): 2721-2727.[13]
Ocena ryzyka wystąpienia nowotworów złośliwych u kobiet z wykrytą mutacją w genie BRCA1
Kobiety ze stężeniem arsenu we krwi poniżej 0,85 µg/l wykazują istotnie około 2-krotnie obniżone ryzyko rozwoju raka w porównaniu do kobiet ze stężeniem arsenu powyżej 0,85 µg/l (OR=2.55; p=0,0006; 95%CI:1,47-4,43).
Częstość występowania nowotworów w zależności od stężenia arsenu we krwi.
| Grupa | Zakres stężeń µg/l | Osoby chore | Osoby zdrowe | OR | 95%CI | p |
| I | <0,85 | 18 | 513 | Ref. | Ref. | Ref. |
| II | >0,85 | 49 | 548 | 2,55 | 1,47-4,43 | 0,0006* |
*wynik istotny statystycznie (p <0,05)
Powyższe wyniki stanowią część publikacji Marciniak W. et al., Blood Arsenic Levels as a Marker of Breast Cancer Risk among BRCA1 Carriers, Cancers 2021, 13(13), 3345. [14]
Ocena ryzyka wystąpienia nowotworów złośliwych u mężczyzn
Wśród mężczyzn, u których stężenie arsenu we krwi wynosi pomiędzy 0,7 a 1,14 µg/l wykazano blisko 5-krotnie obniżone ryzyko zachorowania na raka.
Częstość występowania raków u mężczyzn w zależności od stężenia arsenu we krwi (wybrane zakresy)
| Grupa | Zakres [µg/l] | >Osoby chore | Osoby zdrowe | OR | 95%CI | p |
| I | 0,7-1,14 | 28 | 788 | Ref. | Ref. | Ref. |
| II | <0,7 & > 1,14 | 116 | 2003 | 4,8 | 1,1-2,5 | 0,03* |
*wynik istotny statystycznie (p <0,05) P.437896
Przeżycia chorych z rakiem prostaty
Mężczyźni ze stężeniem arsenu w surowicy w zakresie 0,7-1,0 µg/l wykazują istotnie ponad 3-krotnie zmniejszone ryzyko zgonu w stosunku do podgrupy ze stężeniem arsenu w surowicy < 0,7 µg/l.
Częstość zgonów w zależności od stężenia arsenu w surowicy u mężczyzn z rakiem prostaty w ciągu 5 lat od rozpoznania (wybrane zakresy).
| Grupa | Zakres [µg/l] | Zgony | Żyjący | OR | 95%CI | p |
| I | <0,7 | 22 | 50 | 3,18 | 1,63-6,22 | 0,0009* |
| II | 0,7-1,0 | 22 | 159 | Ref. | Ref. | Ref. |
| III | >1,0 | 21 | 83 | 1,83 | 0,95-3,52 | 0,085 |
*wynik istotny statystycznie (p <0,05) P.437046
Według IARC kadm i jego związki zostały określone jako bezwzględne ludzkie karcynogeny – grupa 1.[12] Niekorzystne działanie kadmu i jego związków może prowadzić do chorób nerek, sercowo-naczyniowych, nadciśnienia, anemii, uszkodzeń wątroby, zaburzeń funkcjonowania narządów płciowych, zaburzeń układu immunologicznego, niedoborów żelaza, miedzi i cynku, a także rozwinięcia choroby nowotworowej.[15] Liczne prace opisują zwiększone stężenia kadmu w materiale biologicznym osób, które zachorowały na raki prostaty[16,17], nerki[18], pęcherza moczowego[19,20], trzustki[21,22] i piersi[23,24].
W literaturze wymienia się trzy główne źródła kadmu: dieta, palenie tytoniu oraz ekspozycja zawodowa[25]. Stężenie kadmu w produktach spożywczych jest silnie zależne od zawartości tego pierwiastka w środowisku – powietrzu, glebie oraz wodzie[25]. Stężenie kadmu we krwi jest mocno skorelowane z paleniem wyrobów tytotniowych. U osób niepalących stężenie Cd jest niższe w porównaniu do palaczy[26]. Grupę zawodową bardziej narażoną na działanie kadmu stanowią pracownicy przemysłu cynkowego, stalowego i miedziowego oraz przy produkcji baterii niklowo-kadmowych, ogniw słonecznych i biżuterii[27].
Ocena ryzyka wystąpienia nowotworów złośliwych u kobiet bez wykrytej mutacji w genie BRCA1
Poniższa tabela przedstawia rozkład osób badanych w wybranym przez nas zakresie. Ryzyko zachorowania na raka jest ponad 8-krotnie zmniejszone wśród kobiet, których stężenie znajduje się w zakresie 0,28-0,33 µg/l.
Częstość występowania raków w zależności od stężenia kadmu we krwi u kobiet nie palących powyżej 50 roku życia (wybrany zakres)
| Grupa | Zakres [µg/l] | Osoby chore | Osoby zdrowe | OR | 95%CI | p |
| I | 0,28-0,33 | 1 | 126 | Ref. | Ref. | Ref. |
| II | <0,28 & >0,33 | 44 | 665 | 8,34 | 1,1-61,1 | 0,009* |
*wynik istotny statystycznie (p <0,05) P.437608
Ocena ryzyka wystąpienia nowotworów złośliwych u kobiet z wykrytą mutacją w genie BRCA1
U kobiet poniżej 51 roku życia ze stężeniem kadmu we krwi ≤0,32 µg/l ryzyko zmniejszone jest ponad 8-krotnie w porównaniu do kobiet z wyższym poziomem kadmu.
Częstość występowania raków w zależności od stężenia kadmu we krwi u kobiet poniżej 51 roku życia (wybrany zakres)
| Grupa | Zakres [µg/l] | Osoby chore | Osoby zdrowe | OR | 95%CI | p |
| I | ≤0,32 | 1 | 92 | Ref. | Ref. | Ref. |
| II | >0,32 | 22 | 244 | 8,30 | 1,1-62,46 | 0,013* |
*wynik istotny statystycznie (p <0,05) PAT.237085
Powyższe wyniki stanowią przedmiot publikacji przesłanej do druku Derkacz R. et al., Blood Cadmium Level and the Risk of Cancer in Women with BRCA1 Mutations, Cancers, 2021.[28]
Ocena ryzyka wystąpienia nowotworów złośliwych u mężczyzn
Mężczyźni, którzy nigdy nie palili papierosów, u których stężenie kadmu we krwi wynosi < 0,14 µg/l mają blisko 6 krotnie obniżone ryzyko zachorowania na raka w stosunku do mężczyzn ze stężeniem kadmu we krwi > 0,28 µg/l.
Częstość występowania raków w zależności od stężenia kadmu we krwi u mężczyzn niepalących papierosów (ćwiartki)
| Ćwiartka | Zakres [µg/l] | Osoby chore | Osoby zdrowe | OR | 95%CI | p |
| I | 0,03-0,14 | 4 | 260 | Ref. | Ref. | Ref. |
| II | 0,14-0,21 | 7 | 257 | 1,77 | 0,51-6,12 | 0,54 |
| III | 0,21-0,28 | 15 | 249 | 3,92 | 1,28-11,96 | 0,02 |
| IV | 0,28-2,34 | 21 | 242 | 5,64 | 1,91-16,67 | 0,0004* |
*wynik istotny statystycznie (p <0,05)P.437897
Cynk jest pierwiastkiem niezbędnym dla prawidłowego funkcjonowania organizmu. Pełni funkcję ochronną przed wolnymi rodnikami, między innymi wchodząc w skład dysmutazy ponadtlenkowej (SOD2). Zaangażowany jest również w procesy immunologiczne, warunkuje prawidłową funkcję skóry czy też błon śluzowych. Bierze udział w magazynowaniu i wydzielaniu insuliny z trzustki, utrzymuje równowagę jonową innych mikroelementów, w tym selenu, magnezu czy miedzi, a także spełnia rolę detoksykacyjną w stosunku do metali ciężkich[29]. Niedobór tego pierwiastka prowadzi do poważnych zaburzeń takich jak: niedobory immunologiczne, zapalenia (m.in. SARS-Cov-2), nieprawidłowe gojenie ran, obniżenie płodności czy też problemy ze wzrokiem[29,30].
Zaobserwowano, że poziom cynku ulega zmianom w komórkach nowotworowych[31]. Prawidłowe komórki nabłonkowe prostaty akumulują cynk, zaś w komórkach rakowych poziom tego pierwiastka jest znacząco obniżony.[32] Uważa się, że cynk ma działanie przeciwnowotworowe hamując wzrost komórek nowotworowych i aktywując apoptozę. Znane są badania oceniające związek między stężeniem cynku a ryzykiem raków, ich wyniki są jednak rozbieżne. Niektóre z tych badań mówią, iż stężenie cynku w surowicy jest wyższe u osób z nowotworem [33–35], natomiast inne, że poziom ten jest niższy.[36] Wyniki przeprowadzonych do tej pory badań sugerują również, że odpowiednia ilość cynku w diecie działa chemoprewencyjnie. Osoby, których dieta jest bogata w cynk wykazują niższe ryzyko raka płuc niż osoby stosujące dietę ubogocynkową (OR 0,71; 95% CI 0,5-0,99). [37] Również ryzyko raka jelita grubego i odbytu jest niższe przy stosowaniu diety bogatocynkowej (RR 0,86; 95% CI 0,73-1,02).[38] Natomiast suplementacja cynkiem w bardzo wysokich dawkach powyżej 100 mg/dzień (zalecane dzienne spożycie cynku wynosi 8 mg/dzień dla kobiet a 12 mg/dzień dla mężczyzn) odnosi odwrotny efekt, znacząco zwiększając ryzyko wystąpienia raka prostaty (RR 2,29; 95% CI 1,06 – 4,95, p=0,03).[39] Poniżej przedstawiono wyniki badań przeprowadzonych w naszym Ośrodku.
Ocena ryzyka wystąpienia nowotworów złośliwych u kobiet bez wykrytej mutacji w genie BRCA1
Kobiety niepalące, powyżej 50 roku życia ze stężeniem cynku we krwi w przedziale 5600-6100 µg/l mają 6,5 krotnie obniżone ryzyko zachorowania na raka w stosunku do kobiet ze stężeniem cynku poniżej 5600 µg/l, a 3,5 krotnie obniżone ryzyko w porównaniu do kobiet ze stężeniem cynku powyżej 6100 µg/l.
Częstość występowania raków w zależności od stężenia cynku we krwi u kobiet niepalących powyżej 50 roku życia
| Grupa | Zakres [µg/l] | Osoby chore | Osoby zdrowe | OR | 95%CI | p |
| I | <5600 | 20 | 198 | 6,5 | 1-89-22,12 | 0,0008* |
| II | 5600-6100 | 3 | 192 | Ref. | Ref. | Ref. |
| III | >6100 | 22 | 399 | 3,5 | 1,04-11,94 | 0,029 |
*wynik istotny statystycznie (p <0,05) P.437571
Ocena ryzyka wystąpienia nowotworów złośliwych u kobiet z wykrytą mutacją w genie BRCA1
Kobiety z mutacją w genie BRCA1, które nie paliły papierosów mają prawie 3 krotnie obniżone ryzyko zachorowania na raka, jeśli ich poziom cynku znajduje się w zakresie 6000-6700 µg/l. Takiej korelacji nie można stwierdzić wśród osób palących papierosy.
Częstość występowania raków w zależności od stężenia cynku we krwi u kobiet będących nosicielkami mutacji w genie BRCA1, które nie paliły papierosów (wybrane zakresy)
| Grupa | Zakres [µg/l] | Osoby chore | Osoby zdrowe | OR | 95%CI | p |
| I | 6000-6700 | 8 | 218 | Ref. | Ref. | Ref. |
| II | <6000&>6700 | 49 | 481 | 2,8 | 1,3-6,0 | 0,006* |
*wynik istotny statystycznie (p <0,05) P.425603
Ocena ryzyka wystąpienia nowotworów złośliwych u mężczyzn
Mężczyźni, którzy nie palili papierosów mają blisko 4 krotnie obniżone ryzyko zachorowania na raka, jeśli ich stężenie cynku we krwi zawiera się w przedziale 5600-6350 µg/l.
Częstość występowania raków w zależności od stężenia cynku we krwi u mężczyzn niepalących (wybrane zakresy)
| Ćwiartka | Zakres [µg/l] | Osoby chore | Osoby zdrowe | OR | 95%CI | p |
| I | 5600-6350 | 5 | 318 | Ref. | Ref. | Ref. |
| II | <5600&>6350 | 41 | 687 | 3,8 | 1,5-9,7 | 0,0018* |
*wynik istotny statystycznie (p <0,05) P.437894
Przeżycia chorych z rakiem piersi
Kobiety ze zdiagnozowanym rakiem piersi oraz stężeniem cynku w surowicy > 1000 µg/l wykazują blisko 6-krotnie zmniejszone ryzyko zgonu w porównaniu do kobiet, u których to stężenie wynosi < 700 µg/l.
Tabela pokazuje częstość zgonów w zależności od stężenia cynku w surowicy u kobiet z rakiem piersi (n=538).
Częstość zgonów w zależności od stężenia cynku w surowicy u kobiet z rakiem piersi w ciągu 10 lat od rozpoznania (wybrane zakresy)
| Grupa | Zakres [µg/l] | Żyjący | Zgony | OR | 95%CI | p |
| I | ≤700 | 33 | 25 | 5,68 | 2,09-15,42 | 0,0003* |
| II | 700-850 | 181 | 54 | 2,24 | 0,91-5,53 | 0,088 |
| III | 851-1000 | 158 | 36 | 1,71 | 0,68-4,31 | 0,30 |
| IV | ≥1000 | 45 | 6 | Ref. | Ref. | Ref. |
*wynik istotny statystycznie (p <0,05) P.434767
Przeżycia chorych z rakiem prostaty
Mężczyźni ze zdiagnozowanym rakiem prostaty, u których stężenie cynku w surowicy zawiera się w przedziale 1000-1200 µg/l wykazują prawie 4-krotnie zmniejszone ryzyko zgonu w stosunku do mężczyzn, u których stężenie to wynosi < 900 µg/l.
Częstość zgonów w zależności od stężenia cynku w surowicy u mężczyzn z rakiem prostaty w ciągu 5 lat od rozpoznania (ćwiartki)
| Grupa | Zakres [µg/l] | Żyjący | Zgony | OR | 95%CI | p |
| I | ≤760,38 | 56 | 34 | 8,4 | 3,31-21,33 | <0,0001* |
| II | 760,39-839,63 | 75 | 14 | 2,58 | 0,94-7,06 | 0,095 |
| III | 839,64-931,72 | 78 | 11 | 1,95 | 0,69-5,53 | 0,31 |
| IV | ≥931,73 | 83 | 6 | Ref. | Ref. | Ref. |
*wynik istotny statystycznie (p <0,05) P.437046
Wśród mężczyzn ze zdiagnozowanym rakiem prostaty, u których stężenie cynku w surowicy zawiera się w przedziale 1000-1200 zaobserwowano blisko 4-krotnie zmniejszone ryzyko zgonu, w stosunku do mężczyzn, u których stężenie cynku jest niższe niż 900 µg/l.
Częstość zgonów w zależności od stężenia cynku w surowicy u mężczyzn z rakiem prostaty ciągu 5 lat od rozpoznania (wybrane zakresy)
| Grupa | Zakres [µg/l] | Żyjący | Zgony | OR | 95%CI | p |
| I | <900 | 180 | 54 | 3,7 | 1,09-12,48 | 0,03* |
| II | 1000-1200 | 37 | 3 | Ref. | Ref. | Ref. |
*wynik istotny statystycznie (p <0,05) P.437046
Powyższe wyniki stanowią przedmiot zgłoszenia patentowego nr P.437046
Przeżycia chorych z rakiem krtani
Wśród osób z rakiem krtani ponad 2-krotnie zmniejszone ryzyko zgonu miały osoby chore ze stężeniem cynku powyżej 688 µg/l w surowicy w porównaniu do osób ze stężeniem <580 µg/l.
Częstość zgonów w zależności od stężenia cynku w surowicy u pacjentów z rakiem krtani w ciągu 5 lat od rozpoznania (tercyle)
| Grupa | Zakres µg/l] | Żyjący | Zgony | OR | 95%CI | p |
| I | 357,76-580,38 | 52 | 52 | 2,45 | 1,4-4,4 | <0,01* |
| II | 584,46-688,89 | 67 | 37 | 1,35 | 0,8-2,4 | 0,31 |
| III | 688,94-1317,87 | 76 | 31 | Ref. | Ref. | Ref. |
*wynik istotny statystycznie (p <0,05) P.427370
Powyższe wyniki stanowią przedmiot publikacji Lubiński J. et al., Survival of Laryngeal Cancer Patients Depending on Zinc Serum Level and Oxidative Stress Genotypes,Biomolecules2021, 11, 865.[40]
Miedź pełni różne funkcje w strukturze białek oraz jako katalizator dzięki zdolności do zmian stopnia utlenienia i redukcji i występuje w stanie utlenionym (Cu2+) lub zredukowanym (Cu+). Jony miedziowe mogą uczestniczyć w szerokim spektrum interakcji z białkami, umożliwiając powstawanie złożonych struktur oraz pośrednicząc w skomplikowanych reakcjach biochemicznych.[41,42] Miedź, podobnie jak inne pierwiastki śladowe, jest z jednej strony niezbędna dla organizmu, z drugiej jednak strony jest bardzo niebezpieczna. Generalnie jednak stany, które charakteryzują się ogólnym lub komórkowo-specyficznym nagromadzeniem miedzi zdarzają się rzadko i najczęściej występują w wyniku określonych zaburzeń o podłożu genetycznym.[43]
Ocena ryzyka wystąpienia nowotworów złośliwych u kobiet bez wykrytej mutacji w genie BRCA1
Kobiety niepalące, w wieku poniżej 50 roku życia ze stężeniem miedzi we krwi pomiędzy 850-1000 µg/l mają niemal 3-krotnie zmniejszone ryzyko zachorowania na raka.
Częstość występowania raków u kobiet niepalących poniżej 50 roku życia, u których nie stwierdzono mutacji w genie BRCA1 (wybrane zakresy).
| Grupa | Zakres [µg/l] | Osoby chore | Osoby zdrowe | OR | 95%CI | p |
| I | 850-1000 | 16 | 493 | Ref. | Ref. | Ref. |
| II | <850 | 13 | 156 | 2,6 | 1,2-5,5 | 0,02* |
*wynik istotny statystycznie (p <0,05) P.438572
Zanieczyszczenie środowiska ołowiem stanowi nieustający problem dla rozwijających się społeczeństw. Toksyczne działanie ołowiu dotyczy głównie jego wpływu na układ krwiotwórczy[44], obwodowy i ośrodkowy układ nerwowy[45] oraz przewód pokarmowy[46]. Ze względu na wszechobecność ołowiu, praktycznie każdy człowiek narażony jest na kontakt z tym pierwiastkiem. Toksyczność ołowiu prowadzi między innymi do zmiany aktywności wielu enzymów oraz zaburzeń funkcji wolnych i strukturalnych białek w komórce[47]. Wiele badań sugeruje, że ważnym molekularnym mechanizmem toksyczności ołowiu jest jego udział w powstawaniu wolnych rodników tlenowych, które odgrywają dużą rolę w powstawaniu uszkodzeń wewnątrzkomórkowych oraz w patogenezie wielu schorzeń, w tym nowotworów złośliwych[48]. Według klasyfikacji karcynogenów IARC, ołów i jego związki należą do grupy 2a i 2b tj. potencjalnie karcinogennych[12].
Ocena ryzyka wystąpienia nowotworów złośliwych u kobiet bez wykrytej mutacji w genie BRCA1
Kobiety, ze stężeniem ołowiu we krwi ≤ 8 µg/l, wykazują istotnie blisko 9-krotnie zmniejszone ryzyko rozwoju raka.
Częstość występowania nowotworów w zależności od stężenia ołowiu u kobiet. (wybrane zakresy).
| Grupa | Zakres [µg/l] | Osoby chore | Osoby zdrowe | OR | 95%CI | p |
| I | ≤8 | 1 | 372 | Ref. | Ref. | Ref. |
| II | >8 | 26 | 1094 | 8,84 | 1,2-65,41 | 0,006* |
*wynik istotny statystycznie (p <0,05) P.433150
Ocena ryzyka wystąpienia nowotworów złośliwych u kobiet z wykrytą mutacją w genie BRCA1
Kobiety, ze stężeniem ołowiu we krwi ≤ 8 µg/l, wykazują istotnie 3-krotnie zmniejszone ryzyko rozwoju raka.
Częstość występowania nowotworów w zależności od stężenia ołowiu u kobiet. (wybrane zakresy).
| Grupa | Zakres [µg/l] | Osoby chore | Osoby zdrowe | OR | 95%CI | p |
| I | ≤8 | 8 | 217 | Ref. | Ref. | Ref. |
| II | >8 | 87 | 812 | 2,9 | 1,4-6,1 | 0,002* |
*wynik istotny statystycznie (p <0,05) P.433150
Ocena ryzyka wystąpienia nowotworów złośliwych u mężczyzn
Mężczyźni poniżej 60 roku życia, niepalący wykazują blisko 8-krotnie obniżone ryzyko zachorowania, jeśli ich stężenie ołowiu jest niższe niż 13,5 µg/l.
Częstość występowania nowotworów w zależności od stężenia ołowiu u mężczyzn niepalących poniżej 60 roku życia (wybrane zakresy).
| Grupa | Zakres [µg/l] | Osoby chore | Osoby zdrowe | OR | 95%CI | p |
| I | <13,5 | 1 | 217 | Ref. | Ref. | Ref. |
| II | >13,5 | 16 | 447 | 7,8 | 1,02-59,0 | 0,017* |
*wynik istotny statystycznie (p <0,05) P.437899
Mężczyźni powyżej 60 roku życia, niepalący wykazują 4-krotnie obniżone ryzyko zachorowania na nowotwory, jeśli ich stężenie ołowiu zawiera się w przedziale 20-50 µg/l we krwi pełnej.
Częstość występowania nowotworów w zależności od stężenia ołowiu u mężczyzn niepalących powyżej 60 roku życia (wybrane zakresy).
| Grupa | Zakres [µg/l] | Osoby chore | Osoby zdrowe | OR | 95%CI | p |
| I | 20-50 | 3 | 74 | Ref. | Ref. | Ref. |
| II | <20 & >50 | 15 | 90 | 4,1 | 1,1-14,8 | 0,02* |
wynik istotny statystycznie (p <0,05) P.437899
Mangan (Mn) jest niezbędnym składnikiem odżywczym biorącym udział w prawidłowym funkcjonowaniu układu odpornościowego, regulacji poziomu cukru we krwi i energii komórkowej, rozmnażania, trawienia, wzrostu kości, krzepnięcia krwi i homeostazy oraz obrony przed reaktywnymi formami tlenu. Funkcje pełnione przez metaloproteiny manganu obejmują oksyreduktazy, transferazy, hydrolazy, liazy, izomerazy oraz ligazy. [49] Mn działa jako kofaktor dla różnych enzymów, w tym arginazy, syntetazy glutaminy (GS), karboksylazy pirogronianowej i dysmutazy ponadtlenkowej Mn (Mn-SOD) [50]. Mn ma tendencję do odkładania się w wątrobie, trzustce, kościach oraz mózgu [50].
W literaturze można znaleźć badania opisujące korelację pomiędzy stężeniem Mn w surowicy a ryzykiem raka piersi oraz jelita grubego. Opublikowane badania mają jednak charakter retrospektywny co powoduje, że nie są one wiarygodne dla stwierdzenia, że mangan jest markerem ryzyka zachorowania na raka. W naszym Ośrodku oceniliśmy korelację pomiędzy stężeniem manganu a przeżyciami kobiet z rakiem piersi.
Przeżycia chorych z rakiem piersi
Kobiety ze zdiagnozowanym rakiem piersi, u których stężenie manganu w surowicy zawiera się w przedziale 1-10 µg/l, wykazują istotnie ponad 1,5 krotnie zmniejszone ryzyko zgonu w odniesieniu do pozostałych kobiet.
Częstość zgonów w zależności od stężenia manganu w surowicy u kobiet z rakiem piersi w ciągu 10 lat od rozpoznania (wybrane zakresy).
| Grupa | Zakres µg/l | Żyjący | Zgony | HR | 95%CI | p |
| I | 1,0-10,0 | 197 | 49 | Ref. | Ref. | Ref. |
| II | <1 & > 10 | 204 | 87 | 1,55 | 1,09-2,20 | 0,01* |
*wynik istotny statystycznie (p <0,05) P.438040
Chrom (Cr) należy do pierwiastków szeroko rozpowszechnionych w skorupie ziemskiej. Pierwiastek ten w niewielkich ilościach jest niezbędny dla prawidłowego funkcjonowania organizmu pełniąc rolę w przemianach metabolicznych glukozy, niektórych białek i tłuszczów [51–53]. Zwiększone dawki chromu mogą mieć silne działanie toksyczne, wpływając destrukcyjnie na wątrobę, nerki i układ krwiotwórczy oraz powodując nowotwory [51,54,55]. Stwierdzono, że Cr(VI) wykazuje silne działanie mutagenne. Wyniki badań asocjacyjnych wskazują na związek pomiędzy stężeniem chromu we krwi oraz ryzykiem nowotworów w obrębie głowy, szyi i jamy ustnej.
W naszym Ośrodku wykonano pracę nad korelacją pomiędzy stężeniem chromu w surowicy a przeżyciem kobiet ze zdiagnozowanym rakiem piersi.
Przeżycia chorych z rakiem piersi
Kobiety ze zdiagnozowanym rakiem piersi, u których stężenie chromu w surowicy zawiera się w przedziale 0,20-3,5 µg/l, wykazują istotnie blisko 2 krotnie zmniejszone ryzyko zgonu.
Częstość zgonów w zależności od stężenia chromu w surowicy u kobiet z rakiem piersi w ciągu 10 lat od rozpoznania (wybrane zakresy).
| Grupa | Zakres µg/l | Żyjący | Zgony | HR | 95%CI | p |
| I | 0,20-3,5 | 202 | 54 | Ref. | Ref. | Ref. |
| II | <0,20 & > 3,5 | 199 | 82 | 1,8 | 1,28-2,54 | 0,0002* |
*wynik istotny statystycznie (p <0,05) P.438042
Kobiety palące papierosy, u których zdiagnozowano nowotwór złośliwy piersi, wykazują istotnie blisko 4,5 krotnie zmniejszone ryzyko zgonu, jeśli ich stężenie chromu w surowicy jest wyższe niż 0,5 µg/l.
Częstość zgonów w zależności od stężenia chromu w surowicy u kobiet palących z rakiem piersi w ciągu 10 lat od rozpoznania (wybrane zakresy).
| Grupa | Zakres µg/l | Żyjący | Zgony | HR | 95%CI | p |
| I | <0,5 | 157 | 56 | 4,46 | 1,39-14,26 | 0,01* |
| II | ≥0,5 | 38 | 3 | Ref. | Ref. | Ref. |
*wynik istotny statystycznie (p <0,05) P.438042
Normy
Pierwiastek | Grupa | Podgrupa | Norma [µg/l] | Publikacja/ Nr zgłoszenia patentowego |
Selen | Kobiety BRCA1 (-) | Palenie (-); < 60 r.ż. Palenie (-); > 60 r.ż. Palenie (+) | 100-110 94-104 110-120 | P.438038 |
| Kobiety BRCA1 (+) | < 50 r.ż. > 50 r.ż. | 70-80 95-120 | P.435603 |
| Mężczyźni | Palenie (-) Palenie (+); < 60 r.ż. Palenie (+); > 60 r.ż. | 100-110 NZ* 115-130 | P.437898 |
Arsen | Kobiety BRCA1 (-) | – | < 0,6 | Marciniak W., 2020[13] P.425602 |
| Kobiety BRCA1 (+) | – | < 0,85 | Marciniak W., 2021[14] |
| Mężczyźni | – | 0,7-1,14 | P.437896 |
Kadm | Kobiety BRCA1 (-) | Palenie (-) < 50 r.ż. Palenie (-) > 50 r.ż. Palenie (+) | NZ* 0,28-0,33 NZ* | P.437608 |
| Kobiety BRCA1 (+) | Palenie (-) Palenie (+) | < 0,27 NZ* | Derkacz R, 2021[28] PAT.237085 |
| Mężczyźni | Palenie (-) Palenie (+) | < 0,21 NZ* | P.437897 |
Cynk | Kobiety BRCA1 (-) | Palenie (-); < 50 r.ż. Palenie (-); > 50 r.ż. Palenie (+) | NZ* 5600-6100 NZ* | P.437571 |
| Kobiety BRCA1 (+) | Palenie (-) Palenie (+) | 6000-6700 6400-6800 | P.425603 |
| Mężczyźni | Palenie (-) Palenie (+) | 5700-6350 NZ* | P.437894 |
Miedź | Kobiety BRCA1 (-) | < 50 r.ż. > 50 r.ż. | 850-1000 < 1000 | P.438572 |
| Kobiety BRCA1 (+) | Palenie (-);< 50 r.ż. Palenie (-); > 50 r.ż. Palenie (+) | 750-825 < 1000 < 1000 | |
| Mężczyźni | – | < 800 | P.437895 |
Ołów | Kobiety BRCA1 (-) | – | ≤ 7,5 | P.438655 |
| Kobiety BRCA1 (+) | – | < 8 | P.433150 |
| Mężczyźni | Palenie (-); < 60 r.ż. Palenie (-); > 60 r.ż. Palenie (+) | < 13,5 < 50 NZ* | P.437899 |
- NZ – dotychczas nie znaleziono korelacji pomiędzy stężeniem pierwiastka a ryzykiem raków w tej podgrupie klinicznej
- Kobiety BRCA1 (-) – kobiety bez wykrytej mutacji w genie BRCA1
- Kobiety BRCA1 (+) – kobiety z wykrytą mutacją w genie BRCA1
- Palenie (-) – osoby niepalące papierosów
- Palenie (+) – osoby palące papierosy
Pierwiastek | Grupa | Norma [µg/l] | Publikacja/ Nr zgłoszenia patentowego |
Selen | Kobiety Mężczyźni | 95-102,5 | Lener M, 2016[10] Lubiński JA, 2018[56] Lubiński J, 20118[57] Pietrzak S, 2019[9] Szwiec M, 2021[8] Rogoża-Janiszewska E., 2021[11] P.437046 |
Arsen | Mężczyźni | 0,75-1,0 | P.437046 |
Cynk | Kobiety Mężczyźni | 1025-1175 | Lubiński J, 2021[40] P.434767 P.437046 |
Miedź | Kobiety Mężczyźni | <1000 ≤ 900 | P.436999 |
Chrom | Kobiety | >0,5 | P.438042 |
Mangan | Kobiety | 1-10 | P.438040 |
- Hariharan, S.; Dharmaraj, S. Selenium and Selenoproteins: It’s Role in Regulation of Inflammation. Inflammopharmacology 2020, 28, 667–695, doi:10.1007/s10787-020-00690-x.
- Combs, G.F.; Clark, L.C.; Turnbull, B.W. An Analysis of Cancer Prevention by Selenium. Biofactors 2001, 14, 153–159, doi:10.1002/biof.5520140120.
- Reddy, V.N.; Giblin, F.J.; Lin, L.R.; Dang, L.; Unakar, N.J.; Musch, D.C.; Boyle, D.L.; Takemoto, L.J.; Ho, Y.S.; Knoernschild, T.; et al. Glutathione Peroxidase-1 Deficiency Leads to Increased Nuclear Light Scattering, Membrane Damage, and Cataract Formation in Gene-Knockout Mice. Invest Ophthalmol Vis Sci 2001, 42, 3247–3255.
- Kuria, A.; Fang, X.; Li, M.; Han, H.; He, J.; Aaseth, J.O.; Cao, Y. Does Dietary Intake of Selenium Protect against Cancer? A Systematic Review and Meta-Analysis of Population-Based Prospective Studies. Crit Rev Food Sci Nutr 2020, 60, 684–694, doi:10.1080/10408398.2018.1548427.
- Jenkins, D.J.A.; Kitts, D.; Giovannucci, E.L.; Sahye-Pudaruth, S.; Paquette, M.; Blanco Mejia, S.; Patel, D.; Kavanagh, M.; Tsirakis, T.; Kendall, C.W.C.; et al. Selenium, Antioxidants, Cardiovascular Disease, and All-Cause Mortality: A Systematic Review and Meta-Analysis of Randomized Controlled Trials. Am J Clin Nutr 2020, 112, 1642–1652, doi:10.1093/ajcn/nqaa245.
- Schomburg, L. The Other View: The Trace Element Selenium as a Micronutrient in Thyroid Disease, Diabetes, and Beyond. Hormones (Athens) 2020, 19, 15–24, doi:10.1007/s42000-019-00150-4.
- Kenfield, S.A.; Van Blarigan, E.L.; DuPre, N.; Stampfer, M.J.; L Giovannucci, E.; Chan, J.M. Selenium Supplementation and Prostate Cancer Mortality. J Natl Cancer Inst 2015, 107, 360, doi:10.1093/jnci/dju360.
- Szwiec, M.; Marciniak, W.; Derkacz, R.; Huzarski, T.; Gronwald, J.; Cybulski, C.; Dębniak, T.; Jakubowska, A.; Lener, M.; Falco, M.; et al. Serum Selenium Level Predicts 10-Year Survival after Breast Cancer. Nutrients 2021, 13, 953, doi:10.3390/nu13030953.
- Pietrzak, S.; Wójcik, J.; Scott, R.J.; Kashyap, A.; Grodzki, T.; Baszuk, P.; Bielewicz, M.; Marciniak, W.; Wójcik, N.; Dębniak, T.; et al. Influence of the Selenium Level on Overall Survival in Lung Cancer. J Trace Elem Med Biol 2019, 56, 46–51, doi:10.1016/j.jtemb.2019.07.010.
- Lener, M.R.; Scott, R.J.; Wiechowska-Kozłowska, A.; Serrano-Fernández, P.; Baszuk, P.; Jaworska-Bieniek, K.; Sukiennicki, G.; Marciniak, W.; Muszyńska, M.; Kładny, J.; et al. Serum Concentrations of Selenium and Copper in Patients Diagnosed with Pancreatic Cancer. Cancer Res Treat 2016, 48, 1056–1064, doi:10.4143/crt.2015.282.
- Rogoża-Janiszewska E. et al Serum Selenium Level and the 10-Year Survival after Melanoma. Biomedicines SI: Role of Trace Elements in Chemoprevention and Cancer Therapy 2021.
- List of Classifications – IARC Monographs on the Identification of Carcinogenic Hazards to Humans Available online: https://monographs.iarc.who.int/list-of-classifications/ (accessed on 20 July 2021).
- Marciniak, W.; Derkacz, R.; Muszyńska, M.; Baszuk, P.; Gronwald, J.; Huzarski, T.; Cybulski, C.; Jakubowska, A.; Falco, M.; Dębniak, T.; et al. Blood Arsenic Levels and the Risk of Familial Breast Cancer in Poland. Int J Cancer 2020, 146, 2721–2727, doi:10.1002/ijc.32595.
- Marciniak, W.; Matoušek, T.; Domchek, S.; Paradiso, A.; Patruno, M.; Irmejs, A.; Roderte, I.; Derkacz, R.; Baszuk, P.; Kuświk, M.; et al. Blood Arsenic Levels as a Marker of Breast Cancer Risk among BRCA1 Carriers. Cancers 2021, 13, 3345, doi:10.3390/cancers13133345.
- Fowler, B.A. Monitoring of Human Populations for Early Markers of Cadmium Toxicity: A Review. Toxicol Appl Pharmacol 2009, 238, 294–300, doi:10.1016/j.taap.2009.05.004.
- Vinceti, M.; Venturelli, M.; Sighinolfi, C.; Trerotoli, P.; Bonvicini, F.; Ferrari, A.; Bianchi, G.; Serio, G.; Bergomi, M.; Vivoli, G. Case-Control Study of Toenail Cadmium and Prostate Cancer Risk in Italy. Sci Total Environ 2007, 373, 77–81, doi:10.1016/j.scitotenv.2006.11.005.
- Qayyum, M.A.; Shah, M.H. Comparative Study of Trace Elements in Blood, Scalp Hair and Nails of Prostate Cancer Patients in Relation to Healthy Donors. Biol Trace Elem Res 2014, 162, 46–57, doi:10.1007/s12011-014-0123-4.
- Pirincci, N.; Gecit, I.; Gunes, M.; Kaba, M.; Tanik, S.; Yuksel, M.B.; Arslan, H.; Demir, H. Levels of Serum Trace Elements in Renal Cell Carcinoma Cases. Asian Pac J Cancer Prev 2013, 14, 499–502, doi:10.7314/apjcp.2013.14.1.499.
- Kellen, E.; Zeegers, M.P.; Hond, E.D.; Buntinx, F. Blood Cadmium May Be Associated with Bladder Carcinogenesis: The Belgian Case-Control Study on Bladder Cancer. Cancer Detect Prev 2007, 31, 77–82, doi:10.1016/j.cdp.2006.12.001.
- Wolf, C.; Strenziok, R.; Kyriakopoulos, A. Elevated Metallothionein-Bound Cadmium Concentrations in Urine from Bladder Carcinoma Patients, Investigated by Size Exclusion Chromatography-Inductively Coupled Plasma Mass Spectrometry. Anal Chim Acta 2009, 631, 218–222, doi:10.1016/j.aca.2008.10.035.
- Farzin, L.; Moassesi, M.E.; Sajadi, F.; Ahmadi Faghih, M.A. Evaluation of Trace Elements in Pancreatic Cancer Patients in Iran. Middle East Journal of Cancer 2013, 4, 79–86.
- Amaral, A.F.S.; Porta, M.; Silverman, D.T.; Milne, R.L.; Kogevinas, M.; Rothman, N.; Cantor, K.P.; Jackson, B.P.; Pumarega, J.A.; López, T.; et al. Pancreatic Cancer Risk and Levels of Trace Elements. Gut 2012, 61, 1583–1588, doi:10.1136/gutjnl-2011-301086.
- Wu, H.-D.I.; Chou, S.-Y.; Chen, D.-R.; Kuo, H.-W. Differentiation of Serum Levels of Trace Elements in Normal and Malignant Breast Patients. Biol Trace Elem Res 2006, 113, 9–18, doi:10.1385/BTER:113:1:19.
- Deeb, M.; El-Sheredy, H.; Mohammed, A. The Role of Serum Trace Elements and Oxidative Stress in Egyptian Breast Cancer Patients. Advances in Breast Cancer Research 2016, 05, 37–47, doi:10.4236/abcr.2016.51004.
- Sabir, S.; Akash, M.S.H.; Fiayyaz, F.; Saleem, U.; Mehmood, M.H.; Rehman, K. Role of Cadmium and Arsenic as Endocrine Disruptors in the Metabolism of Carbohydrates: Inserting the Association into Perspectives. Biomed Pharmacother 2019, 114, 108802, doi:10.1016/j.biopha.2019.108802.
- Lee, J.-E.; Kim, H.-R.; Lee, M.; Kim, N.-H.; Wang, K.-M.; Lee, S.; Park, O.; Hong, E.-J.; Youn, J.-W.; Kim, Y.-Y. Smoking-Related DNA Methylation Is Differentially Associated with Cadmium Concentration in Blood. Biochem Genet 2020, 58, 617–630, doi:10.1007/s10528-020-09965-y.
- Bolam, T.; Bersuder, P.; Burden, R.; Shears, G.; Morris, S.; Warford, L.; Thomas, B.; Nelson, P. Cadmium Levels in Food Containing Crab Brown Meat: A Brief Survey from UK Retailers. Journal of Food Composition and Analysis 2016, 54, 63–69, doi:10.1016/j.jfca.2016.10.005.
- Derkacz R. et al. Blood Cadmium Level and the Risk of Cancer in Women with BRCA1 Mutations. Cancers, SI: Advances in Inherited Breast and Ovarian Cancer and Its Imaging 2021.
- Nasiadek, M.; Stragierowicz, J.; Klimczak, M.; Kilanowicz, A. The Role of Zinc in Selected Female Reproductive System Disorders. Nutrients 2020, 12, 2464, doi:10.3390/nu12082464.
- Puzanowska-Tarasiewicz, H.; Kuźmicka, L.; Tarasiewicz, M. Funkcje biologiczne wybranych pierwiastków i ich związków. 3, 3,. Polski Merkuriusz Lekarski : organ Polskiego Towarzystwa Lekarskiego. 2009, 419–422.
- To, P.K.; Do, M.H.; Cho, J.-H.; Jung, C. Growth Modulatory Role of Zinc in Prostate Cancer and Application to Cancer Therapeutics. Int J Mol Sci 2020, 21, E2991, doi:10.3390/ijms21082991.
- Zaichick VYe, null; Sviridova, T.V.; Zaichick, S.V. Zinc in the Human Prostate Gland: Normal, Hyperplastic and Cancerous. Int Urol Nephrol 1997, 29, 565–574, doi:10.1007/BF02552202.
- Siddiqui, M.K.J.; Jyoti, null; Singh, S.; Mehrotra, P.K.; Singh, K.; Sarangi, R. Comparison of Some Trace Elements Concentration in Blood, Tumor Free Breast and Tumor Tissues of Women with Benign and Malignant Breast Lesions: An Indian Study. Environ Int 2006, 32, 630–637, doi:10.1016/j.envint.2006.02.002.
- Pasha, Q.; Malik, S.A.; Shah, M.H. Statistical Analysis of Trace Metals in the Plasma of Cancer Patients versus Controls. J Hazard Mater 2008, 153, 1215–1221, doi:10.1016/j.jhazmat.2007.09.115.
- el-Ahmady, O.; el-Maraghy, A.; Ibrahim, A.; Ramzy, S. Serum Copper, Zinc, and Iron in Patients with Malignant and Benign Pulmonary Diseases. Nutrition 1995, 11, 498–501.
- Kuo, H.W.; Chen, S.F.; Wu, C.C.; Chen, D.R.; Lee, J.H. Serum and Tissue Trace Elements in Patients with Breast Cancer in Taiwan. Biol Trace Elem Res 2002, 89, 1–11, doi:10.1385/BTER:89:1:1.
- Zhou, W.; Park, S.; Liu, G.; Miller, D.P.; Wang, L.I.; Pothier, L.; Wain, J.C.; Lynch, T.J.; Giovannucci, E.; Christiani, D.C. Dietary Iron, Zinc, and Calcium and the Risk of Lung Cancer. Epidemiology 2005, 16, 772–779, doi:10.1097/01.ede.0000181311.11585.59.
- Zhang, X.; Giovannucci, E.L.; Smith-Warner, S.A.; Wu, K.; Fuchs, C.S.; Pollak, M.; Willett, W.C.; Ma, J. A Prospective Study of Intakes of Zinc and Heme Iron and Colorectal Cancer Risk in Men and Women. Cancer Causes Control 2011, 22, 1627–1637, doi:10.1007/s10552-011-9839-z.
- Leitzmann, M.F.; Stampfer, M.J.; Wu, K.; Colditz, G.A.; Willett, W.C.; Giovannucci, E.L. Zinc Supplement Use and Risk of Prostate Cancer. J Natl Cancer Inst 2003, 95, 1004–1007, doi:10.1093/jnci/95.13.1004.
- Lubiński, J.; Jaworowska, E.; Derkacz, R.; Marciniak, W.; Białkowska, K.; Baszuk, P.; Scott, R.J.; Lubiński, J.A. Survival of Laryngeal Cancer Patients Depending on Zinc Serum Level and Oxidative Stress Genotypes. Biomolecules 2021, 11, 865, doi:10.3390/biom11060865.
- Festa, R.A.; Thiele, D.J. Copper: An Essential Metal in Biology. Curr Biol 2011, 21, R877-883, doi:10.1016/j.cub.2011.09.040.
- Ceramella, J.; Mariconda, A.; Iacopetta, D.; Saturnino, C.; Barbarossa, A.; Caruso, A.; Rosano, C.; Sinicropi, M.S.; Longo, P. From Coins to Cancer Therapy: Gold, Silver and Copper Complexes Targeting Human Topoisomerases. Bioorg Med Chem Lett 2020, 30, 126905, doi:10.1016/j.bmcl.2019.126905.
- Linder, M.C. The Relationship of Copper to DNA Damage and Damage Prevention in Humans. Mutat Res 2012, 733, 83–91, doi:10.1016/j.mrfmmm.2012.03.010.
- Johnson, F.M. The Genetic Effects of Environmental Lead. Mutat Res 1998, 410, 123–140, doi:10.1016/s1383-5742(97)00032-x.
- Marchetti, C. Molecular Targets of Lead in Brain Neurotoxicity. Neurotox Res 2003, 5, 221–236, doi:10.1007/BF03033142.
- Tomczyk, J.; Lewczuk, E.; Abdrzejak, R. Ostre Zatrucia Organicznymi Związkammi Ołowiu.; Medycyna Pracy, 1999; Vol. 50;.
- Cellular Mechanisms of Lead Neurotoxicity – PubMed Available online: https://pubmed.ncbi.nlm.nih.gov/16501435/ (accessed on 20 July 2021).
- Nersesyan, A.; Kundi, M.; Waldherr, M.; Setayesh, T.; Mišík, M.; Wultsch, G.; Filipic, M.; Mazzaron Barcelos, G.R.; Knasmueller, S. Results of Micronucleus Assays with Individuals Who Are Occupationally and Environmentally Exposed to Mercury, Lead and Cadmium. Mutat Res 2016, 770, 119–139, doi:10.1016/j.mrrev.2016.04.002.
- Aschner, M.; Erikson, K. Manganese. Adv Nutr 2017, 8, 520–521, doi:10.3945/an.117.015305.
- Chen, P. Manganese Metabolism in Humans. Front Biosci 2018, 23, 1655–1679, doi:10.2741/4665.
- Bagchi, D.; Stohs, S.J.; Downs, B.W.; Bagchi, M.; Preuss, H.G. Cytotoxicity and Oxidative Mechanisms of Different Forms of Chromium. Toxicology 2002, 180, 5–22, doi:10.1016/s0300-483x(02)00378-5.
- Cefalu, W.T.; Hu, F.B. Role of Chromium in Human Health and in Diabetes. Diabetes Care 2004, 27, 2741–2751, doi:10.2337/diacare.27.11.2741.
- Vincent, J.B. The Biochemistry of Chromium. J Nutr 2000, 130, 715–718, doi:10.1093/jn/130.4.715.
- Anderson, R.A. Chromium Metabolism and Its Role in Disease Processes in Man. Clin Physiol Biochem 1986, 4, 31–41.
- Anderson, R.A. Chromium as an Essential Nutrient for Humans. Regul Toxicol Pharmacol 1997, 26, S35-41, doi:10.1006/rtph.1997.1136.
- Lubinski, J.; Marciniak, W.; Muszynska, M.; Huzarski, T.; Gronwald, J.; Cybulski, C.; Jakubowska, A.; Debniak, T.; Falco, M.; Kladny, J.; et al. Serum Selenium Levels Predict Survival after Breast Cancer. Breast Cancer Res Treat 2018, 167, 591–598, doi:10.1007/s10549-017-4525-9.
- Lubiński, J.; Marciniak, W.; Muszynska, M.; Jaworowska, E.; Sulikowski, M.; Jakubowska, A.; Kaczmarek, K.; Sukiennicki, G.; Falco, M.; Baszuk, P.; et al. Serum Selenium Levels and the Risk of Progression of Laryngeal Cancer. PLoS One 2018, 13, e0184873, doi:10.1371/journal.pone.0184873.
Home » Działalność naukowa
Działalność naukowa
Projekty badawcze
„Prewencja dziedzicznego raka piersi poprzez spersonalizowaną optymalizację stężeń Se, Zn, Fe w organizmie za pomocą suplementów diety”
Umowa nr INNOMED/I/16/NCBR/2014
Czas trwania projektu zgodnie z umową: 01.10.2014-30.09.2019. Projekt współfinansowany przez Unię Europejską w ramach Europejskiego Funduszu Rozwoju Regionalnego.
Partnerem projektu jest Zachodniopomorski Uniwersytet Technologiczny w Szczecinie.
Charakterystyka grup badanych
Grupy badane, których analizy są podstawą poniżej opisanych wyników, zostały utworzone spośród osób, które zostały zarejestrowane w latach 2009-2020 w Ośrodku Nowotworów Dziedzicznych w Szczecinie. Każdy pacjent podpisywał świadomą zgodę na przechowywanie i wykorzystywanie materiału biologicznego w celach naukowych. Próbki krwi i surowicy pobierano w godzinach 8-14, a pacjenci byli na czczo przez co najmniej 4 godziny przed pobraniem. Dla większości pacjentów próbka była pobrana tylko raz, ale w niektórych przypadkach również więcej razy przy okazji kolejnych wizyt. Materiał biologiczny przechowywano w -80° C do momentu oznaczenia stężenia pierwiastków. Każdy z uczestników badania wypełnił ankietę o stanie zdrowia oraz stylu życia.
Do kohorty prospektywnej włączono 2962 zdrowych (bez zdiagnozowanego nowotworu złośliwego) kobiet. W trakcie 42 miesięcznej obserwacji u 148 kobiet zdiagnozowano nowotwór złośliwy.
Charakterystykę grupy przedstawiono w poniższej tabeli.
| Chore (n=148) | Zdrowe (n=2814) | |
| Średnia wieku (zakres) | 56,46 (35-82) | 53 (33-84) |
Palenie papierosów -obecnie -w przeszłości -nigdy | 40 (27,03%) 34 (22,97%) 74 (50 %) | 605 (21,50%) 750 (26,65%) 1459 (51,84%) |
Hormony -nie -tak -brak danych | 93 (62,84%) 54 (36,49%) 1 (0,67%) | 1467 (52,13%) 1316 (46,77%) 31 (1,1%) |
Adnexektomia -nie -tak -brak danych | 135 (91,22%) 9 (6,08%) 4 (2,7%) | 2631 (93,50%) 175 (6,22%) 8 (0,28%) |
Lokalizacje nowotworów złośliwych -pierś -trzon macicy -jelito grube -czerniak -tarczyca -jajnik -szyjka macicy -chłoniak -pęcherz moczowy -płuca -nerka -żołądek -białaczka -szpiczak -glejak -trzustka |
76 (51,4%) 12 (8,1%) 10 (6,8%) 7 (4,7%) 7 (7,73%) 6 (4,05%) 5 (3,38%) 5 (3,38%) 4 (2,7%) 4 (2,7%) 3 (2,03%) 3 (2,03%) 2 (1,35%) 2 (1,35%) 1 (0,68%) 1 (0,68%) | – – – – – – – – – – – – – – – – |
| Chore (n=107) | Zdrowe (n=1217) | |
| Średnia wieku (zakres) | 44,25 (26-66) | 40,5 (25-69) |
| Palenie papierosów
-obecnie -w przeszłości -nigdy -brak danych |
24 (22,43%) 27 (25,23%) 55 (51,4%) 1 (0,93%) |
254 (20,87%) 249 (20,46%) 699 (57,44%) 15 (1,23%) |
| Hormony
-nie -tak -brak danych |
46 (43%) 60 (56,07%) 1 (0,93%) |
603 (49,55%) 592 (48,64%) 22 (1,81%) |
| Adnexektomia
-nie -tak -brak danych |
52 (48,6%) 55 (51,4%) 0 |
688 (56,53%) 510 (41,92%) 19 (1,56%) |
| Lokalizacje nowotworów złośliwych
-pierś -jajnik -szyjka macicy -otrzewna -żołądek -jelito grube -białaczka -trzustka -skóra -krtań -tarczyca -pęcherz moczowy |
80 (74,8%) 15 (14%) 3 (2,8%) 1 (0,9%) 1 (0,9%) 1 (0,9%) 1 (0,9%) 1 (0,9%) 1 (0,9%) 1 (0,9%) 1 (0,9%) 1 (0,9%) |
– – – – – – – – – – – – |
| Chorzy (n=144) | Zdrowi (n=2812) | |
| Średnia wieku (zakres) | 60,5 (36-76) | 52 (31-87) |
| Palenie papierosów
-obecnie -w przeszłości -nigdy |
42 (29,17%) 55 (38,19%) 47 (32,64 %) |
829 (29,48%) 975 (34,67%) 1008 (35,85%) |
| Lokalizacja nowotworu złośliwego
– prostata – skóra – nerka – jelito – pęcherz moczowy – krew – płuca – wątroba – tarczyca – trzustka – żołądek – pierś – przełyk – przysadka – ślinianki – jądra |
58 (40,28%) 16 (11,11%) 13 (9,03%) 13 (9,03%) 12 (8,33%) 9 (6,25%) 6 (4,17%) 4 (2,78%) 4 (2,78%) 2 (1,39%) 2 (1,39%) 1 (0,69%) 1 (0,69%) 1 (0,69%) 1 (0,69%) 1 (0,69%) |
– – – – – – – – – – – – – – – – |
| Żyjący (n=417) | Zgony (n=121) | |
| Średnia wieku (zakres) | 55,87 (25-85) | 61,07 (28-91) |
| Palenie papierosów
-obecnie -w przeszłości -nigdy -brak danych |
89 (21,3%) 112 (26,9%) 206 (49,4%) 10 (2,4%) |
26 (21,5%) 27 (22,3%) 65 (53,7%) 3 (2,5%) |
| Receptor estrogenowy
-dodatni -ujemny -brak danych |
287 (68,8%) 114 (27,3%) 16 (3,8%) |
79 (65,3%) 32 (26,4%) 10 (8,26%) |
| Mutacja w genie BRCA1 | 50 (12%) | 11 (9,1%) |
| Chemioterapia
-tak -nie -brak danych |
211 (50,6%) 174 (41,7%) 32 (7,7%) |
65 (53,7%) 36 (29,8%) 20 (16,5%) |
| Radioterapia
-tak -nie -brak danych |
244 (58,5%) 122 (29,3%) 51 (12,2%) |
56 (46,3%) 35 (28,9%) 30 (24,8%) |
| Tamoxifen
-tak -nie -brak danych |
282 (67,6%) 122 (29,3%) 13 (3,1%) |
79 (65,3%) 33 (27,3%) 9 (7,4%) |
| Rodzaj operacji
-mastektomia -lumpektomia -brak danych |
261 (62,6%) 131 (31,4%) 25 (6%) |
82 (67,8%) 17 (14%) 22 (18,2%) |
Do badania włączono 357 pacjentów ze zdiagnozowanym i potwierdzonym histopatologicznie rakiem prostaty. Krew została zebrana w latach 2009-2015 w momencie diagnozy raka prostaty przed rozpoczęciem leczenia. Średni okres obserwacji dla pacjentów wyniósł 5 lat.
| Gleason | Żyjący (n=293) | Zgony (n=102) |
6 7 8 9 10 Brak danych | 85 (29%) 164 (56%) 20 (6,8%) 17 (5,8%) 2 (0,7%) 5 (1,7%) | 39 (38,2%) 35 (34,3%) 9 (8,8%) 11 (10,8%) 7 (6,9%) 2 (1,96%) |
| Stopień zaawansowania klinicznego 1-2 3 4 brak danych | 7 (2,7%) 232 (79,2%) 51 (17,4%) 2 (0,7%) | 4 (3,9%) 45 (44,1%) 53 (52%) – |
| Radioterpia -tak -nie | 84 (28,7%) 209 (71,3%) | 24 (23,5%) 78 (76,5%) |
| Chemioterpia -tak -nie | 3 (1%) 290 (99%) | 4 (3,9%) 98 (96,1%) |
| Hormonoterpia -tak -nie | 59 (20,1%) 234 (79,9%) | 40 (39,2%) 62 (60,8%) |
| Prostatektomia -tak -nie | 233 (79,5%) 60 (20,5%) | 33 (32,4%) 69 (67,6%) |
| Orchidektomia -tak -nie | 8 (2,7%) 285 (97,3%) | 11 (10,8%) 91 (89,2%) |
| n=315 | % | |
| Wiek zachorowania (średnia, zakres) | 61,1 (41-86) | |
| Płeć
-kobieta -mężczyzna |
49 266 |
15,6 84,4 |
| Stopień zaawansowania klinicznego
1 2 3 4 |
72 42 70 131 |
22,8 13,3 22,2 41,6 |
| Paczkolata (średnia, zakres) | 37,11 (0-150) | |
| Leczenie
-radioterapia -chemioterpia |
142 32 |
45,1 10,1 |
| % | ||
| Płeć
Mężczyźni Kobiety |
196 106 |
64,9 35,1 |
| Wiek, średnia (zakres) | 64,2 (43-86) | – |
| Paczkolata, średnia (zakres) | 33,2 (0-232,8) | – |
| Palenie papierosów
Tak Nie |
283 19 |
93,7 6,3 |
| Stopień zaawansowania klinicznego
1 2 3 4 |
129 75 79 19 |
42,7 24,8 26,2 6,3 |
| Radioterapia
Tak Nie |
78 224 |
25,8 74,2 |
| Chemioterapia
Tak Nie |
105 197 |
34,8 65,2 |
| Histologia
Gruczolakorak Rak płaskonabłonkowy Rak z dużych komórek Rak mieszany z dużych i małych komórek Rak drobnokomórkowy Inne |
136 124 21 5 3 13 |
45 41,1 7 1,7 1 4,3 |
| Osoby chore | |
| Rok urodzenia (zakres) | 1930-1976 |
| Wiek w momencie pobrania, średnia (zakres) | 63,4 (35-84) |
| Płeć
Mężczyzna Kobieta |
59 41 |
| Krewni pierwszego stopnia
Z rakiem trzustki Z rakiem o innej lokalizacji |
4 43 |
| Palenie
Tak Nie |
27 73 |
| Paczkolata, średnia (zakres) | 28,99 (2-50) |
| Żyjący (n=344) | Zgony (n=31) | |
| Wiek (średnia, zakres) | 54,6 (21-90) | 64,3 (38-86) |
| Płeć
-kobieta -mężczyzna |
218 (63%) 126 (37%) |
14 (45%) 17 (55%) |
| Stopień zaawansowania klinicznego
2 3 4-5 |
70 (20%) 145 (42%) 129 (38%) |
1 (3,2%) 12 (39%) 18 (58%) |
Wyniki badań
W organizmie selen działa poprzez białka, do których jest wbudowany w postaci selenocysteiny. Jako składnik selenobiałek selen odgrywa rolę enzymatyczną, jak i strukturalną[1]. Do jednych z ważniejszych funkcji selenobiałek należy udział w produkcji hormonów tarczycy, pobudzanie układu immunologicznego, oraz ochrona przed stresem oksydacyjnym.[2]
Zarówno niedobór jak i nadmiar tego pierwiastka może mieć niekorzystny wpływ na organizm. Prowadzi to do m.in. do zaburzeń pracy serca, zwyrodnienia serca i wątroby, zwiększenia ryzyka choroby nadciśnieniowej, ograniczenia sprawności układu odpornościowego, zaburzenia funkcji tarczycy, zaburzenia mineralizacji kości i prawidłowego wykształcenia zębów oraz zwiększenia ryzyka chorób nowotworowych. [3–7]
Ocena ryzyka wystąpienia nowotworów złośliwych u kobiet bez wykrytej mutacji w genie BRCA1
Kobiety powyżej 60 roku życia, niepalące mają istotnie 4,5 krotnie obniżone ryzyko, jeśli mają stężenie we krwi zawierające się w przedziale 94-104 µg/l. Natomiast kobiety powyżej 60 roku życia, które palą obecnie bądź paliły w przeszłości mają istotnie 3,5 krotnie obniżone ryzyko zachorowania na raka, jeśli mają stężenie selenu we krwi > 110 µg/l.
Częstość występowania raków u kobiet niepalących, powyżej 60 roku życia (wybrane zakresy).
| Grupa | Zakres [µg/l] | Osoby chore | Osoby zdrowe | OR | 95%CI | p |
| I | 94-104 | 3 | 114 | Ref. | Ref. | Ref. |
| II | <94 | 11 | 93 | 4,5 | 1,2-16,6 | 0,02* |
*wynik istotny statystycznie (p <0,05) P.438038
Częstość występowania raków u kobiet palących, powyżej 60 roku życia (wybrane zakresy).
| Grupa | Zakres [µg/l] | Osoby chore | Osoby zdrowe | OR | 95%CI | p |
| I | >110 | 4 | 97 | Ref. | Ref. | Ref. |
| II | <110 | 25 | 171 | 3,5 | 1,2-10,5 | 0,02* |
*wynik istotny statystycznie (p <0,05) P.438038
Ocena ryzyka wystąpienia nowotworów złośliwych u kobiet z wykrytą mutacją w genie BRCA1
Kobiety, poniżej 50 roku życia, ze stężeniem selenu we krwi zawierającym się w przedziale 70-80 µg/l, mają tendencję do blisko 5 krotnie obniżonego ryzyka raka w porównaniu do kobiet ze stężeniami selenu poza przedstawionym przedziałem.
Częstość występowania raków w zależności od stężenia selenu we krwi wśród kobiet poniżej 50 roku życia (wybrane zakresy).
| Grupa | Zakres [µg/l] | Osoby chore | Osoby zdrowe | OR | 95%CI | p |
| I | 70-80 | 1 | 56 | Ref. | Ref. | Ref. |
| II | <70 & >80 | 75 | 904 | 4,6 | 0,6-34,1 | 0,1* |
*wynik nieistotny statystycznie (p >0,05) P.435603
Kobiety, powyżej 50 roku życia, ze stężeniem selenu we krwi zawierającym się w przedziale 95-120 µg/l wykazują ponad 2 krotnie obniżone ryzyko zachorowania na raka w porównaniu do kobiet ze stężeniami selenu poza przedstawionym przedziałem.
Częstość występowania raków w zależności od stężenia selenu we krwi wśród kobiet powyżej 50 roku życia (wybrane zakresy).
| Grupa | Zakres [µg/l] | Osoby chore | Osoby zdrowe | OR | 95%CI | p |
| I | 95-120 | 13 | 156 | Ref. | Ref. | Ref. |
| II | <95 & >120 | 20 | 102 | 2,3 | 1,1-4,9 | 0,03* |
*wynik istotny statystycznie (p <0,05) P.435603
Ocena ryzyka wystąpienia nowotworów złośliwych u mężczyzn
Mężczyźni niepalący papierosów, ze stężeniem selenu we krwi zawierającym się w przedziale 100-110 µg/l wykazują blisko 4 krotnie obniżone ryzyko zachorowania na raka w porównaniu do mężczyzn ze stężeniami selenu poza tym przedziałem.
Częstość występowania raków w zależności od stężenia selenu we krwi wśród mężczyzn niepalących (wybrane zakresy).
| Grupa | Zakres [µg/l] | Osoby chore | Osoby zdrowe | OR | 95%CI | p |
| I | 100-110 | 5 | 260 | Ref. | Ref. | Ref. |
| II | <95 | 20 | 291 | 3,6 | 1,3-9,7 | 0,008* |
*wynik istotny statystycznie (p <0,05) P.437898 Natomiast mężczyźni powyżej 60 roku życia oraz palący papierosy w przeszłości bądź obecnie wykazują blisko 11 krotnie zmniejszone ryzyko zachorowania na nowotwór złośliwy, w przypadku występowania stężenia selenu we krwi >115 µg/l, w porównaniu do mężczyzn ze stężeniem selenu we krwi <115 µg/l.
Częstość występowania raków w zależności od stężenia selenu we krwi wśród mężczyzn palących powyżej 60 roku życia (wybrane zakresy).
| Grupa | Zakres [µg/l] | Osoby chore | Osoby zdrowe | OR | 95%CI | p |
| I | <115 | 1 | 83 | Ref. | Ref. | Ref. |
| II | ≥115 | 56 | 427 | 10,9 | 1,5-79,8 | 0,0013* |
*wynik istotny statystycznie (p <0,05) P.437898
Poniżej przedstawiono krzywą Kaplana-Meier’a dla powyższej korelacji.

Probability of cancer-free – prawdopodobieństwo niezachorowania na raka
Months after testing – czas obserwacji w miesiącach
Przeżycia chorych z rakiem piersi
Kobiety z rakiem piersi mają istotnie większą szansę na 10-letnie przeżycie, jeśli ich stężenie selenu w surowicy wynosi >94,7 µg/l. Kobiety ze stężeniem selenu w surowicy < 70 µg/l mają ponad 25-krotnie zwiększone ryzyko zgonu w porównaniu z podgrupą o stężeniu selenu w surowicy 95-102,5 µg/l.
Częstość zgonów w zależności od stężenia selenu w surowicy u kobiet z rakiem piersi w ciągu 10 lat od rozpoznania (ćwiartki).
| Ćwiartki | Zakres [µg/l] | Żyjący | Zgony | HR | 95%CI | p |
| I | 52,1-76,7 | 89 | 46 | 2,35 | 1,12-4,55 | 0,01* |
| II | 76,8-85,1 | 105 | 29 | 1,52 | 0,76-3,02 | 0,23 |
| III | 85,2-94,6 | 105 | 29 | 1,95 | 1,01-3,76 | 0,047* |
| IV | 94,7-171,5 | 118 | 17 | Ref. | Ref. | Ref. |
*wynik istotny statystycznie (p <0,05)
Częstość zgonów w zależności od stężenia selenu w surowicy u kobiet z rakiem piersi w ciągu 10 lat od rozpoznania (zakresy).
| Ćwiartki | Zakres [µg/l] | Żyjący | Zgony | OR | 95%CI | p |
| I | < 70 | 32 | 28 | Ref. | Ref. | Ref. |
| II | 95-102,5 | 62 | 2 | 27,1 | 6,7-121,2 | <0,0001* |
*wynik istotny statystycznie (p <0,05)
Powyższe wyniki stanowią część publikacji Szwiec M et al., Serum Selenium Level Predicts 10-Years Survival after Breast Cancer; Nutrients 2021, 13(3), 953. [8]
Przeżycia chorych z rakiem prostaty
Mężczyźni z rakiem prostaty oraz stężeniem selenu w surowicy w zakresie 85-105 µg/l wykazują istotnie ponad 8 krotnie zmniejszone ryzyko zgonu w stosunku do podgrupy ze stężeniem selenu w surowicy poniżej 70 µg/l.
Częstość zgonów w zależności od stężenia selenu w surowicy u mężczyzn z rakiem prostaty w ciągu 5 lat od rozpoznania (wybrane zakresy).
| Grupa | Zakres [µg/l] | Żyjący | Zgony | OR | 95%CI | p |
| I | ≤70 | 61 | 33 | 8,6 | 3,4-21,7 | <0,0001* |
| II | 85-105 | 95 | 6 | Ref. | Ref. | Ref. |
*wynik istotny statystycznie (p <0,05) P.437046
Przeżycia chorych z rakiem płuca
Zaobserwowano, że większe szanse na dłuższe przeżycie po diagnozie raka płuca maja osoby, u których stężenie selenu w surowicy wynosi >67,4 µg/l w porównaniu do osób o niskim stężeniu tego pierwiastka w surowicy (<55,1 µg/l).
Częstość zgonów w zależności od stężenia selenu w surowicy u pacjentów z rakiem płuca w I stopniu zaawansowania w ciągu 3 lat od rozpoznania (tertyle).
| Tertyle | Zakres [µg/l] | Ilość osób | OR | 95%CI | p |
| I | 33,46-57,91 | 43 | 2,73 | 1,21-6,11 | 0,01* |
| II | 57,92-68,86 | 42 | 1,88 | 0,83-4,28 | 0,13 |
| III | 69,29-108,27 | 44 | Ref. | Ref. | Ref. |
*wynik istotny statystycznie (p <0,05)
Powyższe wyniki stanowią część publikacji Pietrzak S. et al., Influence of the selenium level on overall survival in lung cancer, Journal of Trace Elements in Medicine and Biology 2019, 56:46-51.[9]
Przeżycia chorych z rakiem trzustki
Pacjenci ze zdiagnozowanym rakiem trzustki mają 3-krotnie większą szansę na 6-miesięczne przeżycie, jeśli ich stężenie selenu w surowicy jest ≥ 63,67 µg/l w porównaniu do pacjentów ze stężeniem selenu poniżej tej wartości.
Częstość zgonów w zależności od stężenia selenu w surowicy u pacjentów z rakiem trzustki w ciągu 6 miesięcy od rozpoznania (wybrane zakresy).
| Grupa | Zakres [µg/l] | Żyjący | Zgony | OR | 95%CI | p |
| I | >< 63,67 | 24 | 33 | 0,4 | 0,1-0,97 | 0,03* |
| II | ≥ 63,67 | 22 | 11 | Ref. | Ref. | Ref. |
Powyższe wyniki stanowią część publikacji Lener M. et al., Serum concentration of Selenium and Copper in Patients Diagnosed with Pancreatic Cancer, Cancer Res Treat., 2016, 48(3):1056-1064.[10]
Przeżycia chorych z czerniakiem złośliwym
Pacjenci ze zdiagnozowanym czerniakiem złośliwym mają istotnie większą szansę na 10-lecie przeżycie, jeśli ich stężenie selenu w surowicy jest wyższe niż 96 µg/l. Pacjenci ze stężeniem selenu w surowicy < 76 µg/l mają blisko 6-krotnie zwiększone ryzyko zgonu w porównaniu z podgrupą o stężeniu selenu w surowicy > 96 µg/l.
Częstość zgonów w zależności od stężenia selenu w surowicy u pacjentów z czerniakiem złośliwym w ciągu 10 lat od rozpoznania (ćwiartki).
| Ćwiartki | Zakres [µg/l] | Żyjący | Zgony | HR | 95%CI | p |
| I | 56,7-76,2 | 78 | 16 | 5,83 | 1,32-25,8 | 0,02* |
| II | 76,4-85,01 | 86 | 7 | 3,37 | 0,7-16,3 | 0,13 |
| III | 85,15-96,06 | 88 | 6 | 3,34 | 0,67-16,7 | 0,14 |
| IV | 96,15-168 | 92 | 2 | Ref. | Ref. | Ref. |
*wynik istotny statystycznie (p<0,05) P.438563
Powyższe wyniki stanowią przedmiot publikacji Rogoża-Janiszewska E. et al., Serum selenium level and the 10-year survival after melanoma, Biomedicines, 2021.[11]
Arsen i jego związki są jednymi z najbardziej rozpoznawalnych trucizn. Według klasyfikacji międzynarodowej agencji do badań nad rakiem (IARC, ang. International Agency for Cancer Research) arsen i jego związki zostały określone jako bezwzględne ludzkie karcynogeny – grupa 1.[12] Różnorodność objawów klinicznych wywołanych inhalacją związkami arsenu lub jego spożyciem jest bardzo duża. W zależności od stężenia, czasu ekspozycji i drogi zaabsorbowania skutki oddziaływania arsenu z tkankami są od stosunkowo niegroźnych na przykład hipopigmentacji, po zagrażające życiu nowotwory (WHO). W świetle istniejących danych literaturowych można stwierdzić, że nie tylko wysokie, ale i nieznacznie podwyższone stężenia arsenu mogą być przyczyną raków, zwłaszcza u kobiet.
Ocena ryzyka wystąpienia nowotworów złośliwych u kobiet bez wykrytej mutacji w genie BRCA1
Kobiety ze stężeniem arsenu we krwi poniżej 0,6 µg/l wykazują istotne blisko 5-krotnie obniżone ryzyko rozwoju raków zwłaszcza raków piersi w porównaniu do kobiet ze stężeniem arsenu powyżej 0,6 µg/l (OR=4,7; p=0,0004; 95%CI:1,9-11,7).
Częstość występowania raków piersi w zależności od stężenia arsenu we krwi (wybrane zakresy)
| Grupa | Zakres stężeń µg/l | Osoby chore | Osoby zdrowe | OR | 95%CI | p |
| I | <0,6 | 5 | 735 | Ref. | Ref. | Ref. |
| II | 0,6-0,81 | 18 | 723 | 3,7 | 1,4-10 | 0,01* |
| III | 0,82-1,25 | 21 | 719 | 4,3 | 1,6-11-5 | 0,002* |
| IV | >1,25 | 32 | 709 | 6,6 | 2,6-17,1 | <0,0001* |
| Wybrane zakresy | ||||||
| I | <0,6 | 5 | 735 | Ref. | Ref. | Ref. |
| II | ≥0,6 | 71 | 2222 | 4,7 | 1,9-11,7 | 0,0004* |
*wynik istotny statystycznie (p <0,05) P.425602
Poniżej przedstawiono krzywą dla powyższej korelacji.

Probability of cancer-free – prawdopodobieństwo niezachorowania na raka/ Months after testing – czas obserwacji w miesiącach
Powyższe wyniki stanowią przedmiot publikacji Marciniak W. et al., Blood arsenic levels and the risk of familial breast cancer in Poland, Int J Cancer, 2020, 146 (10): 2721-2727.[13]
Ocena ryzyka wystąpienia nowotworów złośliwych u kobiet z wykrytą mutacją w genie BRCA1
Kobiety ze stężeniem arsenu we krwi poniżej 0,85 µg/l wykazują istotnie około 2-krotnie obniżone ryzyko rozwoju raka w porównaniu do kobiet ze stężeniem arsenu powyżej 0,85 µg/l (OR=2.55; p=0,0006; 95%CI:1,47-4,43).
Częstość występowania nowotworów w zależności od stężenia arsenu we krwi.
| Grupa | Zakres stężeń µg/l | Osoby chore | Osoby zdrowe | OR | 95%CI | p |
| I | <0,85 | 18 | 513 | Ref. | Ref. | Ref. |
| II | >0,85 | 49 | 548 | 2,55 | 1,47-4,43 | 0,0006* |
*wynik istotny statystycznie (p <0,05)
Powyższe wyniki stanowią część publikacji Marciniak W. et al., Blood Arsenic Levels as a Marker of Breast Cancer Risk among BRCA1 Carriers, Cancers 2021, 13(13), 3345. [14]
Ocena ryzyka wystąpienia nowotworów złośliwych u mężczyzn
Wśród mężczyzn, u których stężenie arsenu we krwi wynosi pomiędzy 0,7 a 1,14 µg/l wykazano blisko 5-krotnie obniżone ryzyko zachorowania na raka.
Częstość występowania raków u mężczyzn w zależności od stężenia arsenu we krwi (wybrane zakresy)
| Grupa | Zakres [µg/l] | >Osoby chore | Osoby zdrowe | OR | 95%CI | p |
| I | 0,7-1,14 | 28 | 788 | Ref. | Ref. | Ref. |
| II | <0,7 & > 1,14 | 116 | 2003 | 4,8 | 1,1-2,5 | 0,03* |
*wynik istotny statystycznie (p <0,05) P.437896
Przeżycia chorych z rakiem prostaty
Mężczyźni ze stężeniem arsenu w surowicy w zakresie 0,7-1,0 µg/l wykazują istotnie ponad 3-krotnie zmniejszone ryzyko zgonu w stosunku do podgrupy ze stężeniem arsenu w surowicy < 0,7 µg/l.
Częstość zgonów w zależności od stężenia arsenu w surowicy u mężczyzn z rakiem prostaty w ciągu 5 lat od rozpoznania (wybrane zakresy).
| Grupa | Zakres [µg/l] | Zgony | Żyjący | OR | 95%CI | p |
| I | <0,7 | 22 | 50 | 3,18 | 1,63-6,22 | 0,0009* |
| II | 0,7-1,0 | 22 | 159 | Ref. | Ref. | Ref. |
| III | >1,0 | 21 | 83 | 1,83 | 0,95-3,52 | 0,085 |
*wynik istotny statystycznie (p <0,05) P.437046
Według IARC kadm i jego związki zostały określone jako bezwzględne ludzkie karcynogeny – grupa 1.[12] Niekorzystne działanie kadmu i jego związków może prowadzić do chorób nerek, sercowo-naczyniowych, nadciśnienia, anemii, uszkodzeń wątroby, zaburzeń funkcjonowania narządów płciowych, zaburzeń układu immunologicznego, niedoborów żelaza, miedzi i cynku, a także rozwinięcia choroby nowotworowej.[15] Liczne prace opisują zwiększone stężenia kadmu w materiale biologicznym osób, które zachorowały na raki prostaty[16,17], nerki[18], pęcherza moczowego[19,20], trzustki[21,22] i piersi[23,24].
W literaturze wymienia się trzy główne źródła kadmu: dieta, palenie tytoniu oraz ekspozycja zawodowa[25]. Stężenie kadmu w produktach spożywczych jest silnie zależne od zawartości tego pierwiastka w środowisku – powietrzu, glebie oraz wodzie[25]. Stężenie kadmu we krwi jest mocno skorelowane z paleniem wyrobów tytotniowych. U osób niepalących stężenie Cd jest niższe w porównaniu do palaczy[26]. Grupę zawodową bardziej narażoną na działanie kadmu stanowią pracownicy przemysłu cynkowego, stalowego i miedziowego oraz przy produkcji baterii niklowo-kadmowych, ogniw słonecznych i biżuterii[27].
Ocena ryzyka wystąpienia nowotworów złośliwych u kobiet bez wykrytej mutacji w genie BRCA1
Poniższa tabela przedstawia rozkład osób badanych w wybranym przez nas zakresie. Ryzyko zachorowania na raka jest ponad 8-krotnie zmniejszone wśród kobiet, których stężenie znajduje się w zakresie 0,28-0,33 µg/l.
Częstość występowania raków w zależności od stężenia kadmu we krwi u kobiet nie palących powyżej 50 roku życia (wybrany zakres)
| Grupa | Zakres [µg/l] | Osoby chore | Osoby zdrowe | OR | 95%CI | p |
| I | 0,28-0,33 | 1 | 126 | Ref. | Ref. | Ref. |
| II | <0,28 & >0,33 | 44 | 665 | 8,34 | 1,1-61,1 | 0,009* |
*wynik istotny statystycznie (p <0,05) P.437608
Ocena ryzyka wystąpienia nowotworów złośliwych u kobiet z wykrytą mutacją w genie BRCA1
U kobiet poniżej 51 roku życia ze stężeniem kadmu we krwi ≤0,32 µg/l ryzyko zmniejszone jest ponad 8-krotnie w porównaniu do kobiet z wyższym poziomem kadmu.
Częstość występowania raków w zależności od stężenia kadmu we krwi u kobiet poniżej 51 roku życia (wybrany zakres)
| Grupa | Zakres [µg/l] | Osoby chore | Osoby zdrowe | OR | 95%CI | p |
| I | ≤0,32 | 1 | 92 | Ref. | Ref. | Ref. |
| II | >0,32 | 22 | 244 | 8,30 | 1,1-62,46 | 0,013* |
*wynik istotny statystycznie (p <0,05) PAT.237085
Powyższe wyniki stanowią przedmiot publikacji przesłanej do druku Derkacz R. et al., Blood Cadmium Level and the Risk of Cancer in Women with BRCA1 Mutations, Cancers, 2021.[28]
Ocena ryzyka wystąpienia nowotworów złośliwych u mężczyzn
Mężczyźni, którzy nigdy nie palili papierosów, u których stężenie kadmu we krwi wynosi < 0,14 µg/l mają blisko 6 krotnie obniżone ryzyko zachorowania na raka w stosunku do mężczyzn ze stężeniem kadmu we krwi > 0,28 µg/l.
Częstość występowania raków w zależności od stężenia kadmu we krwi u mężczyzn niepalących papierosów (ćwiartki)
| Ćwiartka | Zakres [µg/l] | Osoby chore | Osoby zdrowe | OR | 95%CI | p |
| I | 0,03-0,14 | 4 | 260 | Ref. | Ref. | Ref. |
| II | 0,14-0,21 | 7 | 257 | 1,77 | 0,51-6,12 | 0,54 |
| III | 0,21-0,28 | 15 | 249 | 3,92 | 1,28-11,96 | 0,02 |
| IV | 0,28-2,34 | 21 | 242 | 5,64 | 1,91-16,67 | 0,0004* |
*wynik istotny statystycznie (p <0,05)P.437897
Cynk jest pierwiastkiem niezbędnym dla prawidłowego funkcjonowania organizmu. Pełni funkcję ochronną przed wolnymi rodnikami, między innymi wchodząc w skład dysmutazy ponadtlenkowej (SOD2). Zaangażowany jest również w procesy immunologiczne, warunkuje prawidłową funkcję skóry czy też błon śluzowych. Bierze udział w magazynowaniu i wydzielaniu insuliny z trzustki, utrzymuje równowagę jonową innych mikroelementów, w tym selenu, magnezu czy miedzi, a także spełnia rolę detoksykacyjną w stosunku do metali ciężkich[29]. Niedobór tego pierwiastka prowadzi do poważnych zaburzeń takich jak: niedobory immunologiczne, zapalenia (m.in. SARS-Cov-2), nieprawidłowe gojenie ran, obniżenie płodności czy też problemy ze wzrokiem[29,30].
Zaobserwowano, że poziom cynku ulega zmianom w komórkach nowotworowych[31]. Prawidłowe komórki nabłonkowe prostaty akumulują cynk, zaś w komórkach rakowych poziom tego pierwiastka jest znacząco obniżony.[32] Uważa się, że cynk ma działanie przeciwnowotworowe hamując wzrost komórek nowotworowych i aktywując apoptozę. Znane są badania oceniające związek między stężeniem cynku a ryzykiem raków, ich wyniki są jednak rozbieżne. Niektóre z tych badań mówią, iż stężenie cynku w surowicy jest wyższe u osób z nowotworem [33–35], natomiast inne, że poziom ten jest niższy.[36] Wyniki przeprowadzonych do tej pory badań sugerują również, że odpowiednia ilość cynku w diecie działa chemoprewencyjnie. Osoby, których dieta jest bogata w cynk wykazują niższe ryzyko raka płuc niż osoby stosujące dietę ubogocynkową (OR 0,71; 95% CI 0,5-0,99). [37] Również ryzyko raka jelita grubego i odbytu jest niższe przy stosowaniu diety bogatocynkowej (RR 0,86; 95% CI 0,73-1,02).[38] Natomiast suplementacja cynkiem w bardzo wysokich dawkach powyżej 100 mg/dzień (zalecane dzienne spożycie cynku wynosi 8 mg/dzień dla kobiet a 12 mg/dzień dla mężczyzn) odnosi odwrotny efekt, znacząco zwiększając ryzyko wystąpienia raka prostaty (RR 2,29; 95% CI 1,06 – 4,95, p=0,03).[39] Poniżej przedstawiono wyniki badań przeprowadzonych w naszym Ośrodku.
Ocena ryzyka wystąpienia nowotworów złośliwych u kobiet bez wykrytej mutacji w genie BRCA1
Kobiety niepalące, powyżej 50 roku życia ze stężeniem cynku we krwi w przedziale 5600-6100 µg/l mają 6,5 krotnie obniżone ryzyko zachorowania na raka w stosunku do kobiet ze stężeniem cynku poniżej 5600 µg/l, a 3,5 krotnie obniżone ryzyko w porównaniu do kobiet ze stężeniem cynku powyżej 6100 µg/l.
Częstość występowania raków w zależności od stężenia cynku we krwi u kobiet niepalących powyżej 50 roku życia
| Grupa | Zakres [µg/l] | Osoby chore | Osoby zdrowe | OR | 95%CI | p |
| I | <5600 | 20 | 198 | 6,5 | 1-89-22,12 | 0,0008* |
| II | 5600-6100 | 3 | 192 | Ref. | Ref. | Ref. |
| III | >6100 | 22 | 399 | 3,5 | 1,04-11,94 | 0,029 |
*wynik istotny statystycznie (p <0,05) P.437571
Ocena ryzyka wystąpienia nowotworów złośliwych u kobiet z wykrytą mutacją w genie BRCA1
Kobiety z mutacją w genie BRCA1, które nie paliły papierosów mają prawie 3 krotnie obniżone ryzyko zachorowania na raka, jeśli ich poziom cynku znajduje się w zakresie 6000-6700 µg/l. Takiej korelacji nie można stwierdzić wśród osób palących papierosy.
Częstość występowania raków w zależności od stężenia cynku we krwi u kobiet będących nosicielkami mutacji w genie BRCA1, które nie paliły papierosów (wybrane zakresy)
| Grupa | Zakres [µg/l] | Osoby chore | Osoby zdrowe | OR | 95%CI | p |
| I | 6000-6700 | 8 | 218 | Ref. | Ref. | Ref. |
| II | <6000&>6700 | 49 | 481 | 2,8 | 1,3-6,0 | 0,006* |
*wynik istotny statystycznie (p <0,05) P.425603
Ocena ryzyka wystąpienia nowotworów złośliwych u mężczyzn
Mężczyźni, którzy nie palili papierosów mają blisko 4 krotnie obniżone ryzyko zachorowania na raka, jeśli ich stężenie cynku we krwi zawiera się w przedziale 5600-6350 µg/l.
Częstość występowania raków w zależności od stężenia cynku we krwi u mężczyzn niepalących (wybrane zakresy)
| Ćwiartka | Zakres [µg/l] | Osoby chore | Osoby zdrowe | OR | 95%CI | p |
| I | 5600-6350 | 5 | 318 | Ref. | Ref. | Ref. |
| II | <5600&>6350 | 41 | 687 | 3,8 | 1,5-9,7 | 0,0018* |
*wynik istotny statystycznie (p <0,05) P.437894
Przeżycia chorych z rakiem piersi
Kobiety ze zdiagnozowanym rakiem piersi oraz stężeniem cynku w surowicy > 1000 µg/l wykazują blisko 6-krotnie zmniejszone ryzyko zgonu w porównaniu do kobiet, u których to stężenie wynosi < 700 µg/l.
Tabela pokazuje częstość zgonów w zależności od stężenia cynku w surowicy u kobiet z rakiem piersi (n=538).
Częstość zgonów w zależności od stężenia cynku w surowicy u kobiet z rakiem piersi w ciągu 10 lat od rozpoznania (wybrane zakresy)
| Grupa | Zakres [µg/l] | Żyjący | Zgony | OR | 95%CI | p |
| I | ≤700 | 33 | 25 | 5,68 | 2,09-15,42 | 0,0003* |
| II | 700-850 | 181 | 54 | 2,24 | 0,91-5,53 | 0,088 |
| III | 851-1000 | 158 | 36 | 1,71 | 0,68-4,31 | 0,30 |
| IV | ≥1000 | 45 | 6 | Ref. | Ref. | Ref. |
*wynik istotny statystycznie (p <0,05) P.434767
Przeżycia chorych z rakiem prostaty
Mężczyźni ze zdiagnozowanym rakiem prostaty, u których stężenie cynku w surowicy zawiera się w przedziale 1000-1200 µg/l wykazują prawie 4-krotnie zmniejszone ryzyko zgonu w stosunku do mężczyzn, u których stężenie to wynosi < 900 µg/l.
Częstość zgonów w zależności od stężenia cynku w surowicy u mężczyzn z rakiem prostaty w ciągu 5 lat od rozpoznania (ćwiartki)
| Grupa | Zakres [µg/l] | Żyjący | Zgony | OR | 95%CI | p |
| I | ≤760,38 | 56 | 34 | 8,4 | 3,31-21,33 | <0,0001* |
| II | 760,39-839,63 | 75 | 14 | 2,58 | 0,94-7,06 | 0,095 |
| III | 839,64-931,72 | 78 | 11 | 1,95 | 0,69-5,53 | 0,31 |
| IV | ≥931,73 | 83 | 6 | Ref. | Ref. | Ref. |
*wynik istotny statystycznie (p <0,05) P.437046
Wśród mężczyzn ze zdiagnozowanym rakiem prostaty, u których stężenie cynku w surowicy zawiera się w przedziale 1000-1200 zaobserwowano blisko 4-krotnie zmniejszone ryzyko zgonu, w stosunku do mężczyzn, u których stężenie cynku jest niższe niż 900 µg/l.
Częstość zgonów w zależności od stężenia cynku w surowicy u mężczyzn z rakiem prostaty ciągu 5 lat od rozpoznania (wybrane zakresy)
| Grupa | Zakres [µg/l] | Żyjący | Zgony | OR | 95%CI | p |
| I | <900 | 180 | 54 | 3,7 | 1,09-12,48 | 0,03* |
| II | 1000-1200 | 37 | 3 | Ref. | Ref. | Ref. |
*wynik istotny statystycznie (p <0,05) P.437046
Powyższe wyniki stanowią przedmiot zgłoszenia patentowego nr P.437046
Przeżycia chorych z rakiem krtani
Wśród osób z rakiem krtani ponad 2-krotnie zmniejszone ryzyko zgonu miały osoby chore ze stężeniem cynku powyżej 688 µg/l w surowicy w porównaniu do osób ze stężeniem <580 µg/l.
Częstość zgonów w zależności od stężenia cynku w surowicy u pacjentów z rakiem krtani w ciągu 5 lat od rozpoznania (tercyle)
| Grupa | Zakres µg/l] | Żyjący | Zgony | OR | 95%CI | p |
| I | 357,76-580,38 | 52 | 52 | 2,45 | 1,4-4,4 | <0,01* |
| II | 584,46-688,89 | 67 | 37 | 1,35 | 0,8-2,4 | 0,31 |
| III | 688,94-1317,87 | 76 | 31 | Ref. | Ref. | Ref. |
*wynik istotny statystycznie (p <0,05) P.427370
Powyższe wyniki stanowią przedmiot publikacji Lubiński J. et al., Survival of Laryngeal Cancer Patients Depending on Zinc Serum Level and Oxidative Stress Genotypes,Biomolecules2021, 11, 865.[40]
Miedź pełni różne funkcje w strukturze białek oraz jako katalizator dzięki zdolności do zmian stopnia utlenienia i redukcji i występuje w stanie utlenionym (Cu2+) lub zredukowanym (Cu+). Jony miedziowe mogą uczestniczyć w szerokim spektrum interakcji z białkami, umożliwiając powstawanie złożonych struktur oraz pośrednicząc w skomplikowanych reakcjach biochemicznych.[41,42] Miedź, podobnie jak inne pierwiastki śladowe, jest z jednej strony niezbędna dla organizmu, z drugiej jednak strony jest bardzo niebezpieczna. Generalnie jednak stany, które charakteryzują się ogólnym lub komórkowo-specyficznym nagromadzeniem miedzi zdarzają się rzadko i najczęściej występują w wyniku określonych zaburzeń o podłożu genetycznym.[43]
Ocena ryzyka wystąpienia nowotworów złośliwych u kobiet bez wykrytej mutacji w genie BRCA1
Kobiety niepalące, w wieku poniżej 50 roku życia ze stężeniem miedzi we krwi pomiędzy 850-1000 µg/l mają niemal 3-krotnie zmniejszone ryzyko zachorowania na raka.
Częstość występowania raków u kobiet niepalących poniżej 50 roku życia, u których nie stwierdzono mutacji w genie BRCA1 (wybrane zakresy).
| Grupa | Zakres [µg/l] | Osoby chore | Osoby zdrowe | OR | 95%CI | p |
| I | 850-1000 | 16 | 493 | Ref. | Ref. | Ref. |
| II | <850 | 13 | 156 | 2,6 | 1,2-5,5 | 0,02* |
*wynik istotny statystycznie (p <0,05) P.438572
Zanieczyszczenie środowiska ołowiem stanowi nieustający problem dla rozwijających się społeczeństw. Toksyczne działanie ołowiu dotyczy głównie jego wpływu na układ krwiotwórczy[44], obwodowy i ośrodkowy układ nerwowy[45] oraz przewód pokarmowy[46]. Ze względu na wszechobecność ołowiu, praktycznie każdy człowiek narażony jest na kontakt z tym pierwiastkiem. Toksyczność ołowiu prowadzi między innymi do zmiany aktywności wielu enzymów oraz zaburzeń funkcji wolnych i strukturalnych białek w komórce[47]. Wiele badań sugeruje, że ważnym molekularnym mechanizmem toksyczności ołowiu jest jego udział w powstawaniu wolnych rodników tlenowych, które odgrywają dużą rolę w powstawaniu uszkodzeń wewnątrzkomórkowych oraz w patogenezie wielu schorzeń, w tym nowotworów złośliwych[48]. Według klasyfikacji karcynogenów IARC, ołów i jego związki należą do grupy 2a i 2b tj. potencjalnie karcinogennych[12].
Ocena ryzyka wystąpienia nowotworów złośliwych u kobiet bez wykrytej mutacji w genie BRCA1
Kobiety, ze stężeniem ołowiu we krwi ≤ 8 µg/l, wykazują istotnie blisko 9-krotnie zmniejszone ryzyko rozwoju raka.
Częstość występowania nowotworów w zależności od stężenia ołowiu u kobiet. (wybrane zakresy).
| Grupa | Zakres [µg/l] | Osoby chore | Osoby zdrowe | OR | 95%CI | p |
| I | ≤8 | 1 | 372 | Ref. | Ref. | Ref. |
| II | >8 | 26 | 1094 | 8,84 | 1,2-65,41 | 0,006* |
*wynik istotny statystycznie (p <0,05) P.433150
Ocena ryzyka wystąpienia nowotworów złośliwych u kobiet z wykrytą mutacją w genie BRCA1
Kobiety, ze stężeniem ołowiu we krwi ≤ 8 µg/l, wykazują istotnie 3-krotnie zmniejszone ryzyko rozwoju raka.
Częstość występowania nowotworów w zależności od stężenia ołowiu u kobiet. (wybrane zakresy).
| Grupa | Zakres [µg/l] | Osoby chore | Osoby zdrowe | OR | 95%CI | p |
| I | ≤8 | 8 | 217 | Ref. | Ref. | Ref. |
| II | >8 | 87 | 812 | 2,9 | 1,4-6,1 | 0,002* |
*wynik istotny statystycznie (p <0,05) P.433150
Ocena ryzyka wystąpienia nowotworów złośliwych u mężczyzn
Mężczyźni poniżej 60 roku życia, niepalący wykazują blisko 8-krotnie obniżone ryzyko zachorowania, jeśli ich stężenie ołowiu jest niższe niż 13,5 µg/l.
Częstość występowania nowotworów w zależności od stężenia ołowiu u mężczyzn niepalących poniżej 60 roku życia (wybrane zakresy).
| Grupa | Zakres [µg/l] | Osoby chore | Osoby zdrowe | OR | 95%CI | p |
| I | <13,5 | 1 | 217 | Ref. | Ref. | Ref. |
| II | >13,5 | 16 | 447 | 7,8 | 1,02-59,0 | 0,017* |
*wynik istotny statystycznie (p <0,05) P.437899
Mężczyźni powyżej 60 roku życia, niepalący wykazują 4-krotnie obniżone ryzyko zachorowania na nowotwory, jeśli ich stężenie ołowiu zawiera się w przedziale 20-50 µg/l we krwi pełnej.
Częstość występowania nowotworów w zależności od stężenia ołowiu u mężczyzn niepalących powyżej 60 roku życia (wybrane zakresy).
| Grupa | Zakres [µg/l] | Osoby chore | Osoby zdrowe | OR | 95%CI | p |
| I | 20-50 | 3 | 74 | Ref. | Ref. | Ref. |
| II | <20 & >50 | 15 | 90 | 4,1 | 1,1-14,8 | 0,02* |
wynik istotny statystycznie (p <0,05) P.437899
Mangan (Mn) jest niezbędnym składnikiem odżywczym biorącym udział w prawidłowym funkcjonowaniu układu odpornościowego, regulacji poziomu cukru we krwi i energii komórkowej, rozmnażania, trawienia, wzrostu kości, krzepnięcia krwi i homeostazy oraz obrony przed reaktywnymi formami tlenu. Funkcje pełnione przez metaloproteiny manganu obejmują oksyreduktazy, transferazy, hydrolazy, liazy, izomerazy oraz ligazy. [49] Mn działa jako kofaktor dla różnych enzymów, w tym arginazy, syntetazy glutaminy (GS), karboksylazy pirogronianowej i dysmutazy ponadtlenkowej Mn (Mn-SOD) [50]. Mn ma tendencję do odkładania się w wątrobie, trzustce, kościach oraz mózgu [50].
W literaturze można znaleźć badania opisujące korelację pomiędzy stężeniem Mn w surowicy a ryzykiem raka piersi oraz jelita grubego. Opublikowane badania mają jednak charakter retrospektywny co powoduje, że nie są one wiarygodne dla stwierdzenia, że mangan jest markerem ryzyka zachorowania na raka. W naszym Ośrodku oceniliśmy korelację pomiędzy stężeniem manganu a przeżyciami kobiet z rakiem piersi.
Przeżycia chorych z rakiem piersi
Kobiety ze zdiagnozowanym rakiem piersi, u których stężenie manganu w surowicy zawiera się w przedziale 1-10 µg/l, wykazują istotnie ponad 1,5 krotnie zmniejszone ryzyko zgonu w odniesieniu do pozostałych kobiet.
Częstość zgonów w zależności od stężenia manganu w surowicy u kobiet z rakiem piersi w ciągu 10 lat od rozpoznania (wybrane zakresy).
| Grupa | Zakres µg/l | Żyjący | Zgony | HR | 95%CI | p |
| I | 1,0-10,0 | 197 | 49 | Ref. | Ref. | Ref. |
| II | <1 & > 10 | 204 | 87 | 1,55 | 1,09-2,20 | 0,01* |
*wynik istotny statystycznie (p <0,05) P.438040
Chrom (Cr) należy do pierwiastków szeroko rozpowszechnionych w skorupie ziemskiej. Pierwiastek ten w niewielkich ilościach jest niezbędny dla prawidłowego funkcjonowania organizmu pełniąc rolę w przemianach metabolicznych glukozy, niektórych białek i tłuszczów [51–53]. Zwiększone dawki chromu mogą mieć silne działanie toksyczne, wpływając destrukcyjnie na wątrobę, nerki i układ krwiotwórczy oraz powodując nowotwory [51,54,55]. Stwierdzono, że Cr(VI) wykazuje silne działanie mutagenne. Wyniki badań asocjacyjnych wskazują na związek pomiędzy stężeniem chromu we krwi oraz ryzykiem nowotworów w obrębie głowy, szyi i jamy ustnej.
W naszym Ośrodku wykonano pracę nad korelacją pomiędzy stężeniem chromu w surowicy a przeżyciem kobiet ze zdiagnozowanym rakiem piersi.
Przeżycia chorych z rakiem piersi
Kobiety ze zdiagnozowanym rakiem piersi, u których stężenie chromu w surowicy zawiera się w przedziale 0,20-3,5 µg/l, wykazują istotnie blisko 2 krotnie zmniejszone ryzyko zgonu.
Częstość zgonów w zależności od stężenia chromu w surowicy u kobiet z rakiem piersi w ciągu 10 lat od rozpoznania (wybrane zakresy).
| Grupa | Zakres µg/l | Żyjący | Zgony | HR | 95%CI | p |
| I | 0,20-3,5 | 202 | 54 | Ref. | Ref. | Ref. |
| II | <0,20 & > 3,5 | 199 | 82 | 1,8 | 1,28-2,54 | 0,0002* |
*wynik istotny statystycznie (p <0,05) P.438042
Kobiety palące papierosy, u których zdiagnozowano nowotwór złośliwy piersi, wykazują istotnie blisko 4,5 krotnie zmniejszone ryzyko zgonu, jeśli ich stężenie chromu w surowicy jest wyższe niż 0,5 µg/l.
Częstość zgonów w zależności od stężenia chromu w surowicy u kobiet palących z rakiem piersi w ciągu 10 lat od rozpoznania (wybrane zakresy).
| Grupa | Zakres µg/l | Żyjący | Zgony | HR | 95%CI | p |
| I | <0,5 | 157 | 56 | 4,46 | 1,39-14,26 | 0,01* |
| II | ≥0,5 | 38 | 3 | Ref. | Ref. | Ref. |
*wynik istotny statystycznie (p <0,05) P.438042
Normy
Pierwiastek | Grupa | Podgrupa | Norma [µg/l] | Publikacja/ Nr zgłoszenia patentowego |
Selen | Kobiety BRCA1 (-) | Palenie (-); < 60 r.ż. Palenie (-); > 60 r.ż. Palenie (+) | 100-110 94-104 110-120 | P.438038 |
| Kobiety BRCA1 (+) | < 50 r.ż. > 50 r.ż. | 70-80 95-120 | P.435603 |
| Mężczyźni | Palenie (-) Palenie (+); < 60 r.ż. Palenie (+); > 60 r.ż. | 100-110 NZ* 115-130 | P.437898 |
Arsen | Kobiety BRCA1 (-) | – | < 0,6 | Marciniak W., 2020[13] P.425602 |
| Kobiety BRCA1 (+) | – | < 0,85 | Marciniak W., 2021[14] |
| Mężczyźni | – | 0,7-1,14 | P.437896 |
Kadm | Kobiety BRCA1 (-) | Palenie (-) < 50 r.ż. Palenie (-) > 50 r.ż. Palenie (+) | NZ* 0,28-0,33 NZ* | P.437608 |
| Kobiety BRCA1 (+) | Palenie (-) Palenie (+) | < 0,27 NZ* | Derkacz R, 2021[28] PAT.237085 |
| Mężczyźni | Palenie (-) Palenie (+) | < 0,21 NZ* | P.437897 |
Cynk | Kobiety BRCA1 (-) | Palenie (-); < 50 r.ż. Palenie (-); > 50 r.ż. Palenie (+) | NZ* 5600-6100 NZ* | P.437571 |
| Kobiety BRCA1 (+) | Palenie (-) Palenie (+) | 6000-6700 6400-6800 | P.425603 |
| Mężczyźni | Palenie (-) Palenie (+) | 5700-6350 NZ* | P.437894 |
Miedź | Kobiety BRCA1 (-) | < 50 r.ż. > 50 r.ż. | 850-1000 < 1000 | P.438572 |
| Kobiety BRCA1 (+) | Palenie (-);< 50 r.ż. Palenie (-); > 50 r.ż. Palenie (+) | 750-825 < 1000 < 1000 | |
| Mężczyźni | – | < 800 | P.437895 |
Ołów | Kobiety BRCA1 (-) | – | ≤ 7,5 | P.438655 |
| Kobiety BRCA1 (+) | – | < 8 | P.433150 |
| Mężczyźni | Palenie (-); < 60 r.ż. Palenie (-); > 60 r.ż. Palenie (+) | < 13,5 < 50 NZ* | P.437899 |
- NZ – dotychczas nie znaleziono korelacji pomiędzy stężeniem pierwiastka a ryzykiem raków w tej podgrupie klinicznej
- Kobiety BRCA1 (-) – kobiety bez wykrytej mutacji w genie BRCA1
- Kobiety BRCA1 (+) – kobiety z wykrytą mutacją w genie BRCA1
- Palenie (-) – osoby niepalące papierosów
- Palenie (+) – osoby palące papierosy
| Pierwiastek | Grupa | Norma [µg/l] | >Publikacja/Nr zgłoszenia patentowego |
| Selen | Kobiety Mężczyźni | 95-102,5 | Lener M, 2016[10]; Lubiński JA, 2018 [56]; Lubiński J, 20118n [57];Pietrzak S, 2019[9]; Szwiec M, 2021[8]; Rogoża-Janiszewska E., 2021[11]; P.437046 |
| Arsen | Mężczyźni | 0,75-1,0 | P.437046 |
| Cynk | Kobiety Mężczyźni | 1025-1175 | Lubiński J, 2021[40]; P.434767; P.437046 |
| Miedź | Kobiety Mężczyźni | <1000 ≤ 900 | P.436999 |
| Chrom | Kobiety | >0,5 | P.438042 |
| Mangan | Kobiety | 1-10 | P.438040 |
- Hariharan, S.; Dharmaraj, S. Selenium and Selenoproteins: It’s Role in Regulation of Inflammation. Inflammopharmacology 2020, 28, 667–695, doi:10.1007/s10787-020-00690-x.
- Combs, G.F.; Clark, L.C.; Turnbull, B.W. An Analysis of Cancer Prevention by Selenium. Biofactors 2001, 14, 153–159, doi:10.1002/biof.5520140120.
- Reddy, V.N.; Giblin, F.J.; Lin, L.R.; Dang, L.; Unakar, N.J.; Musch, D.C.; Boyle, D.L.; Takemoto, L.J.; Ho, Y.S.; Knoernschild, T.; et al. Glutathione Peroxidase-1 Deficiency Leads to Increased Nuclear Light Scattering, Membrane Damage, and Cataract Formation in Gene-Knockout Mice. Invest Ophthalmol Vis Sci 2001, 42, 3247–3255.
- Kuria, A.; Fang, X.; Li, M.; Han, H.; He, J.; Aaseth, J.O.; Cao, Y. Does Dietary Intake of Selenium Protect against Cancer? A Systematic Review and Meta-Analysis of Population-Based Prospective Studies. Crit Rev Food Sci Nutr 2020, 60, 684–694, doi:10.1080/10408398.2018.1548427.
- Jenkins, D.J.A.; Kitts, D.; Giovannucci, E.L.; Sahye-Pudaruth, S.; Paquette, M.; Blanco Mejia, S.; Patel, D.; Kavanagh, M.; Tsirakis, T.; Kendall, C.W.C.; et al. Selenium, Antioxidants, Cardiovascular Disease, and All-Cause Mortality: A Systematic Review and Meta-Analysis of Randomized Controlled Trials. Am J Clin Nutr 2020, 112, 1642–1652, doi:10.1093/ajcn/nqaa245.
- Schomburg, L. The Other View: The Trace Element Selenium as a Micronutrient in Thyroid Disease, Diabetes, and Beyond. Hormones (Athens) 2020, 19, 15–24, doi:10.1007/s42000-019-00150-4.
- Kenfield, S.A.; Van Blarigan, E.L.; DuPre, N.; Stampfer, M.J.; L Giovannucci, E.; Chan, J.M. Selenium Supplementation and Prostate Cancer Mortality. J Natl Cancer Inst 2015, 107, 360, doi:10.1093/jnci/dju360.
- Szwiec, M.; Marciniak, W.; Derkacz, R.; Huzarski, T.; Gronwald, J.; Cybulski, C.; Dębniak, T.; Jakubowska, A.; Lener, M.; Falco, M.; et al. Serum Selenium Level Predicts 10-Year Survival after Breast Cancer. Nutrients 2021, 13, 953, doi:10.3390/nu13030953.
- Pietrzak, S.; Wójcik, J.; Scott, R.J.; Kashyap, A.; Grodzki, T.; Baszuk, P.; Bielewicz, M.; Marciniak, W.; Wójcik, N.; Dębniak, T.; et al. Influence of the Selenium Level on Overall Survival in Lung Cancer. J Trace Elem Med Biol 2019, 56, 46–51, doi:10.1016/j.jtemb.2019.07.010.
- Lener, M.R.; Scott, R.J.; Wiechowska-Kozłowska, A.; Serrano-Fernández, P.; Baszuk, P.; Jaworska-Bieniek, K.; Sukiennicki, G.; Marciniak, W.; Muszyńska, M.; Kładny, J.; et al. Serum Concentrations of Selenium and Copper in Patients Diagnosed with Pancreatic Cancer. Cancer Res Treat 2016, 48, 1056–1064, doi:10.4143/crt.2015.282.
- Rogoża-Janiszewska E. et al Serum Selenium Level and the 10-Year Survival after Melanoma. Biomedicines SI: Role of Trace Elements in Chemoprevention and Cancer Therapy 2021.
- List of Classifications – IARC Monographs on the Identification of Carcinogenic Hazards to Humans Available online: https://monographs.iarc.who.int/list-of-classifications/ (accessed on 20 July 2021).
- Marciniak, W.; Derkacz, R.; Muszyńska, M.; Baszuk, P.; Gronwald, J.; Huzarski, T.; Cybulski, C.; Jakubowska, A.; Falco, M.; Dębniak, T.; et al. Blood Arsenic Levels and the Risk of Familial Breast Cancer in Poland. Int J Cancer 2020, 146, 2721–2727, doi:10.1002/ijc.32595.
- Marciniak, W.; Matoušek, T.; Domchek, S.; Paradiso, A.; Patruno, M.; Irmejs, A.; Roderte, I.; Derkacz, R.; Baszuk, P.; Kuświk, M.; et al. Blood Arsenic Levels as a Marker of Breast Cancer Risk among BRCA1 Carriers. Cancers 2021, 13, 3345, doi:10.3390/cancers13133345.
- Fowler, B.A. Monitoring of Human Populations for Early Markers of Cadmium Toxicity: A Review. Toxicol Appl Pharmacol 2009, 238, 294–300, doi:10.1016/j.taap.2009.05.004.
- Vinceti, M.; Venturelli, M.; Sighinolfi, C.; Trerotoli, P.; Bonvicini, F.; Ferrari, A.; Bianchi, G.; Serio, G.; Bergomi, M.; Vivoli, G. Case-Control Study of Toenail Cadmium and Prostate Cancer Risk in Italy. Sci Total Environ 2007, 373, 77–81, doi:10.1016/j.scitotenv.2006.11.005.
- Qayyum, M.A.; Shah, M.H. Comparative Study of Trace Elements in Blood, Scalp Hair and Nails of Prostate Cancer Patients in Relation to Healthy Donors. Biol Trace Elem Res 2014, 162, 46–57, doi:10.1007/s12011-014-0123-4.
- Pirincci, N.; Gecit, I.; Gunes, M.; Kaba, M.; Tanik, S.; Yuksel, M.B.; Arslan, H.; Demir, H. Levels of Serum Trace Elements in Renal Cell Carcinoma Cases. Asian Pac J Cancer Prev 2013, 14, 499–502, doi:10.7314/apjcp.2013.14.1.499.
- Kellen, E.; Zeegers, M.P.; Hond, E.D.; Buntinx, F. Blood Cadmium May Be Associated with Bladder Carcinogenesis: The Belgian Case-Control Study on Bladder Cancer. Cancer Detect Prev 2007, 31, 77–82, doi:10.1016/j.cdp.2006.12.001.
- Wolf, C.; Strenziok, R.; Kyriakopoulos, A. Elevated Metallothionein-Bound Cadmium Concentrations in Urine from Bladder Carcinoma Patients, Investigated by Size Exclusion Chromatography-Inductively Coupled Plasma Mass Spectrometry. Anal Chim Acta 2009, 631, 218–222, doi:10.1016/j.aca.2008.10.035.
- Farzin, L.; Moassesi, M.E.; Sajadi, F.; Ahmadi Faghih, M.A. Evaluation of Trace Elements in Pancreatic Cancer Patients in Iran. Middle East Journal of Cancer 2013, 4, 79–86.
- Amaral, A.F.S.; Porta, M.; Silverman, D.T.; Milne, R.L.; Kogevinas, M.; Rothman, N.; Cantor, K.P.; Jackson, B.P.; Pumarega, J.A.; López, T.; et al. Pancreatic Cancer Risk and Levels of Trace Elements. Gut 2012, 61, 1583–1588, doi:10.1136/gutjnl-2011-301086.
- Wu, H.-D.I.; Chou, S.-Y.; Chen, D.-R.; Kuo, H.-W. Differentiation of Serum Levels of Trace Elements in Normal and Malignant Breast Patients. Biol Trace Elem Res 2006, 113, 9–18, doi:10.1385/BTER:113:1:19.
- Deeb, M.; El-Sheredy, H.; Mohammed, A. The Role of Serum Trace Elements and Oxidative Stress in Egyptian Breast Cancer Patients. Advances in Breast Cancer Research 2016, 05, 37–47, doi:10.4236/abcr.2016.51004.
- Sabir, S.; Akash, M.S.H.; Fiayyaz, F.; Saleem, U.; Mehmood, M.H.; Rehman, K. Role of Cadmium and Arsenic as Endocrine Disruptors in the Metabolism of Carbohydrates: Inserting the Association into Perspectives. Biomed Pharmacother 2019, 114, 108802, doi:10.1016/j.biopha.2019.108802.
- Lee, J.-E.; Kim, H.-R.; Lee, M.; Kim, N.-H.; Wang, K.-M.; Lee, S.; Park, O.; Hong, E.-J.; Youn, J.-W.; Kim, Y.-Y. Smoking-Related DNA Methylation Is Differentially Associated with Cadmium Concentration in Blood. Biochem Genet 2020, 58, 617–630, doi:10.1007/s10528-020-09965-y.
- Bolam, T.; Bersuder, P.; Burden, R.; Shears, G.; Morris, S.; Warford, L.; Thomas, B.; Nelson, P. Cadmium Levels in Food Containing Crab Brown Meat: A Brief Survey from UK Retailers. Journal of Food Composition and Analysis 2016, 54, 63–69, doi:10.1016/j.jfca.2016.10.005.
- Derkacz R. et al. Blood Cadmium Level and the Risk of Cancer in Women with BRCA1 Mutations. Cancers, SI: Advances in Inherited Breast and Ovarian Cancer and Its Imaging 2021.
- Nasiadek, M.; Stragierowicz, J.; Klimczak, M.; Kilanowicz, A. The Role of Zinc in Selected Female Reproductive System Disorders. Nutrients 2020, 12, 2464, doi:10.3390/nu12082464.
- Puzanowska-Tarasiewicz, H.; Kuźmicka, L.; Tarasiewicz, M. Funkcje biologiczne wybranych pierwiastków i ich związków. 3, 3,. Polski Merkuriusz Lekarski : organ Polskiego Towarzystwa Lekarskiego. 2009, 419–422.
- To, P.K.; Do, M.H.; Cho, J.-H.; Jung, C. Growth Modulatory Role of Zinc in Prostate Cancer and Application to Cancer Therapeutics. Int J Mol Sci 2020, 21, E2991, doi:10.3390/ijms21082991.
- Zaichick VYe, null; Sviridova, T.V.; Zaichick, S.V. Zinc in the Human Prostate Gland: Normal, Hyperplastic and Cancerous. Int Urol Nephrol 1997, 29, 565–574, doi:10.1007/BF02552202.
- Siddiqui, M.K.J.; Jyoti, null; Singh, S.; Mehrotra, P.K.; Singh, K.; Sarangi, R. Comparison of Some Trace Elements Concentration in Blood, Tumor Free Breast and Tumor Tissues of Women with Benign and Malignant Breast Lesions: An Indian Study. Environ Int 2006, 32, 630–637, doi:10.1016/j.envint.2006.02.002.
- Pasha, Q.; Malik, S.A.; Shah, M.H. Statistical Analysis of Trace Metals in the Plasma of Cancer Patients versus Controls. J Hazard Mater 2008, 153, 1215–1221, doi:10.1016/j.jhazmat.2007.09.115.
- el-Ahmady, O.; el-Maraghy, A.; Ibrahim, A.; Ramzy, S. Serum Copper, Zinc, and Iron in Patients with Malignant and Benign Pulmonary Diseases. Nutrition 1995, 11, 498–501.
- Kuo, H.W.; Chen, S.F.; Wu, C.C.; Chen, D.R.; Lee, J.H. Serum and Tissue Trace Elements in Patients with Breast Cancer in Taiwan. Biol Trace Elem Res 2002, 89, 1–11, doi:10.1385/BTER:89:1:1.
- Zhou, W.; Park, S.; Liu, G.; Miller, D.P.; Wang, L.I.; Pothier, L.; Wain, J.C.; Lynch, T.J.; Giovannucci, E.; Christiani, D.C. Dietary Iron, Zinc, and Calcium and the Risk of Lung Cancer. Epidemiology 2005, 16, 772–779, doi:10.1097/01.ede.0000181311.11585.59.
- Zhang, X.; Giovannucci, E.L.; Smith-Warner, S.A.; Wu, K.; Fuchs, C.S.; Pollak, M.; Willett, W.C.; Ma, J. A Prospective Study of Intakes of Zinc and Heme Iron and Colorectal Cancer Risk in Men and Women. Cancer Causes Control 2011, 22, 1627–1637, doi:10.1007/s10552-011-9839-z.
- Leitzmann, M.F.; Stampfer, M.J.; Wu, K.; Colditz, G.A.; Willett, W.C.; Giovannucci, E.L. Zinc Supplement Use and Risk of Prostate Cancer. J Natl Cancer Inst 2003, 95, 1004–1007, doi:10.1093/jnci/95.13.1004.
- Lubiński, J.; Jaworowska, E.; Derkacz, R.; Marciniak, W.; Białkowska, K.; Baszuk, P.; Scott, R.J.; Lubiński, J.A. Survival of Laryngeal Cancer Patients Depending on Zinc Serum Level and Oxidative Stress Genotypes. Biomolecules 2021, 11, 865, doi:10.3390/biom11060865.
- Festa, R.A.; Thiele, D.J. Copper: An Essential Metal in Biology. Curr Biol 2011, 21, R877-883, doi:10.1016/j.cub.2011.09.040.
- Ceramella, J.; Mariconda, A.; Iacopetta, D.; Saturnino, C.; Barbarossa, A.; Caruso, A.; Rosano, C.; Sinicropi, M.S.; Longo, P. From Coins to Cancer Therapy: Gold, Silver and Copper Complexes Targeting Human Topoisomerases. Bioorg Med Chem Lett 2020, 30, 126905, doi:10.1016/j.bmcl.2019.126905.
- Linder, M.C. The Relationship of Copper to DNA Damage and Damage Prevention in Humans. Mutat Res 2012, 733, 83–91, doi:10.1016/j.mrfmmm.2012.03.010.
- Johnson, F.M. The Genetic Effects of Environmental Lead. Mutat Res 1998, 410, 123–140, doi:10.1016/s1383-5742(97)00032-x.
- Marchetti, C. Molecular Targets of Lead in Brain Neurotoxicity. Neurotox Res 2003, 5, 221–236, doi:10.1007/BF03033142.
- Tomczyk, J.; Lewczuk, E.; Abdrzejak, R. Ostre Zatrucia Organicznymi Związkammi Ołowiu.; Medycyna Pracy, 1999; Vol. 50;.
- Cellular Mechanisms of Lead Neurotoxicity – PubMed Available online: https://pubmed.ncbi.nlm.nih.gov/16501435/ (accessed on 20 July 2021).
- Nersesyan, A.; Kundi, M.; Waldherr, M.; Setayesh, T.; Mišík, M.; Wultsch, G.; Filipic, M.; Mazzaron Barcelos, G.R.; Knasmueller, S. Results of Micronucleus Assays with Individuals Who Are Occupationally and Environmentally Exposed to Mercury, Lead and Cadmium. Mutat Res 2016, 770, 119–139, doi:10.1016/j.mrrev.2016.04.002.
- Aschner, M.; Erikson, K. Manganese. Adv Nutr 2017, 8, 520–521, doi:10.3945/an.117.015305.
- Chen, P. Manganese Metabolism in Humans. Front Biosci 2018, 23, 1655–1679, doi:10.2741/4665.
- Bagchi, D.; Stohs, S.J.; Downs, B.W.; Bagchi, M.; Preuss, H.G. Cytotoxicity and Oxidative Mechanisms of Different Forms of Chromium. Toxicology 2002, 180, 5–22, doi:10.1016/s0300-483x(02)00378-5.
- Cefalu, W.T.; Hu, F.B. Role of Chromium in Human Health and in Diabetes. Diabetes Care 2004, 27, 2741–2751, doi:10.2337/diacare.27.11.2741.
- Vincent, J.B. The Biochemistry of Chromium. J Nutr 2000, 130, 715–718, doi:10.1093/jn/130.4.715.
- Anderson, R.A. Chromium Metabolism and Its Role in Disease Processes in Man. Clin Physiol Biochem 1986, 4, 31–41.
- Anderson, R.A. Chromium as an Essential Nutrient for Humans. Regul Toxicol Pharmacol 1997, 26, S35-41, doi:10.1006/rtph.1997.1136.
- Lubinski, J.; Marciniak, W.; Muszynska, M.; Huzarski, T.; Gronwald, J.; Cybulski, C.; Jakubowska, A.; Debniak, T.; Falco, M.; Kladny, J.; et al. Serum Selenium Levels Predict Survival after Breast Cancer. Breast Cancer Res Treat 2018, 167, 591–598, doi:10.1007/s10549-017-4525-9.
- Lubiński, J.; Marciniak, W.; Muszynska, M.; Jaworowska, E.; Sulikowski, M.; Jakubowska, A.; Kaczmarek, K.; Sukiennicki, G.; Falco, M.; Baszuk, P.; et al. Serum Selenium Levels and the Risk of Progression of Laryngeal Cancer. PLoS One 2018, 13, e0184873, doi:10.1371/journal.pone.0184873.
Home » Działalność naukowa
Działalność naukowa
Projekty badawcze
„Prewencja dziedzicznego raka piersi poprzez spersonalizowaną optymalizację stężeń Se, Zn, Fe w organizmie za pomocą suplementów diety”
Umowa nr INNOMED/I/16/NCBR/2014
Czas trwania projektu zgodnie z umową: 01.10.2014-30.09.2019. Projekt współfinansowany przez Unię Europejską w ramach Europejskiego Funduszu Rozwoju Regionalnego.
Partnerem projektu jest Zachodniopomorski Uniwersytet Technologiczny w Szczecinie.
Charakterystyka grup badanych
Grupy badane, których analizy są podstawą poniżej opisanych wyników, zostały utworzone spośród osób, które zostały zarejestrowane w latach 2009-2020 w Ośrodku Nowotworów Dziedzicznych w Szczecinie. Każdy pacjent podpisywał świadomą zgodę na przechowywanie i wykorzystywanie materiału biologicznego w celach naukowych. Próbki krwi i surowicy pobierano w godzinach 8-14, a pacjenci byli na czczo przez co najmniej 4 godziny przed pobraniem. Dla większości pacjentów próbka była pobrana tylko raz, ale w niektórych przypadkach również więcej razy przy okazji kolejnych wizyt. Materiał biologiczny przechowywano w -80° C do momentu oznaczenia stężenia pierwiastków. Każdy z uczestników badania wypełnił ankietę o stanie zdrowia oraz stylu życia.
Do kohorty prospektywnej włączono 2962 zdrowych (bez zdiagnozowanego nowotworu złośliwego) kobiet. W trakcie 42 miesięcznej obserwacji u 148 kobiet zdiagnozowano nowotwór złośliwy.
Charakterystykę grupy przedstawiono w poniższej tabeli.
| Chore (n=148) | Zdrowe (n=2814) |
Średnia wieku (zakres) | 56,46 (35-82) | 53 (33-84) |
Palenie papierosów -obecnie -w przeszłości -nigdy |
40 (27,03%) 34 (22,97%) 74 (50 %) |
605 (21,50%) 750 (26,65%) 1459 (51,84%) |
Hormony -nie -tak -brak danych |
93 (62,84%) 54 (36,49%) 1 (0,67%) |
1467 (52,13%) 1316 (46,77%) 31 (1,1%) |
Adnexektomia -nie -tak -brak danych |
135 (91,22%) 9 (6,08%) 4 (2,7%) |
2631 (93,50%) 175 (6,22%) 8 (0,28%) |
Lokalizacje nowotworów złośliwych -pierś -trzon macicy -jelito grube -czerniak -tarczyca -jajnik -szyjka macicy -chłoniak -pęcherz moczowy -płuca -nerka -żołądek -białaczka -szpiczak -glejak -trzustka |
76 (51,4%) 12 (8,1%) 10 (6,8%) 7 (4,7%) 7 (7,73%) 6 (4,05%) 5 (3,38%) 5 (3,38%) 4 (2,7%) 4 (2,7%) 3 (2,03%) 3 (2,03%) 2 (1,35%) 2 (1,35%) 1 (0,68%) 1 (0,68%) |
– – – – – – – – – – – – – – – – |
Do kohorty prospektywnej włączono 1324 zdrowe (bez zdiagnozowanego nowotworu złośliwego) kobiety, u których wykryto mutację w genie BRCA1. Uczestniczki zostały poddane średnio 40 miesięcznej obserwacji, w trakcie której u 107 kobiet zdiagnozowano nowotwór złośliwy.
Charakterystykę grupy przedstawiono w poniższej tabeli.
| Chore (n=107) | Zdrowe (n=1217) |
Średnia wieku (zakres) | 44,25 (26-66) | 40,5 (25-69) |
Palenie papierosów -obecnie -w przeszłości -nigdy -brak danych |
24 (22,43%) 27 (25,23%) 55 (51,4%) 1 (0,93%) |
254 (20,87%) 249 (20,46%) 699 (57,44%) 15 (1,23%) |
Hormony -nie -tak -brak danych |
46 (43%) 60 (56,07%) 1 (0,93%) |
603 (49,55%) 592 (48,64%) 22 (1,81%) |
Adnexektomia -nie -tak -brak danych |
52 (48,6%) 55 (51,4%) 0 |
688 (56,53%) 510 (41,92%) 19 (1,56%) |
Lokalizacje nowotworów złośliwych -pierś -jajnik -szyjka macicy -otrzewna -żołądek -jelito grube -białaczka -trzustka -skóra -krtań -tarczyca -pęcherz moczowy |
80 (74,8%) 15 (14%) 3 (2,8%) 1 (0,9%) 1 (0,9%) 1 (0,9%) 1 (0,9%) 1 (0,9%) 1 (0,9%) 1 (0,9%) 1 (0,9%) 1 (0,9%) |
– – – – – – – – – – – – |
Do kohorty prospektywnej włączono zdrowych (bez zdiagnozowanego nowotworu złośliwego) 2956 mężczyzn. Zostali oni poddani średnio 76 miesięcznej obserwacji, w trakcie której u 144 mężczyzn zdiagnozowano nowotwór złośliwy. Każdy z uczestników badania wypełnił ankietę o stanie zdrowia oraz stylu życia.
Charakterystykę grupy prospektywnej przedstawiono w poniższej tabeli.
| Chorzy (n=144) | Zdrowi (n=2812) |
Średnia wieku (zakres) | 60,5 (36-76) | 52 (31-87) |
Palenie papierosów -obecnie -w przeszłości -nigdy |
42 (29,17%) 55 (38,19%) 47 (32,64 %) |
829 (29,48%) 975 (34,67%) 1008 (35,85%) |
Lokalizacja nowotworu złośliwego – prostata – skóra – nerka – jelito – pęcherz moczowy – krew – płuca – wątroba – tarczyca – trzustka – żołądek – pierś – przełyk – przysadka – ślinianki – jądra |
58 (40,28%) 16 (11,11%) 13 (9,03%) 13 (9,03%) 12 (8,33%) 9 (6,25%) 6 (4,17%) 4 (2,78%) 4 (2,78%) 2 (1,39%) 2 (1,39%) 1 (0,69%) 1 (0,69%) 1 (0,69%) 1 (0,69%) 1 (0,69%) |
– – – – – – – – – – – – – – – – |
Do badań włączono 538 pacjentek ze zdiagnozowanym i potwierdzonym histopatologicznie rakiem piersi. Krew została zebrana w latach 2009-2015 w momencie diagnozy raka piersi, przed rozpoczęciem leczenia. W 2020 roku zebrano informację o zgonach w trakcie obserwacji prospektywnej. Uzyskano ją z Departamentu Ewidencji Państwowych – Ministerstwa Cyfryzacji. Średni okres obserwacji dla pacjentek żyjących wyniósł 9 lat (zakres 5-12 lat).
Charakterystyka grupy została przedstawiona w poniższej tabeli.
| Żyjący (n=417) | Zgony (n=121) |
Średnia wieku (zakres) | 55,87 (25-85) | 61,07 (28-91) |
Palenie papierosów -obecnie -w przeszłości -nigdy -brak danych |
89 (21,3%) 112 (26,9%) 206 (49,4%) 10 (2,4%) |
26 (21,5%) 27 (22,3%) 65 (53,7%) 3 (2,5%) |
Receptor estrogenowy -dodatni -ujemny -brak danych |
287 (68,8%) 114 (27,3%) 16 (3,8%) |
79 (65,3%) 32 (26,4%) 10 (8,26%) |
Mutacja w genie BRCA1 | 50 (12%) | 11 (9,1%) |
Chemioterapia -tak -nie -brak danych |
211 (50,6%) 174 (41,7%) 32 (7,7%) |
65 (53,7%) 36 (29,8%) 20 (16,5%) |
Radioterapia -tak -nie -brak danych |
244 (58,5%) 122 (29,3%) 51 (12,2%) |
56 (46,3%) 35 (28,9%) 30 (24,8%) |
Tamoxifen -tak -nie -brak danych |
282 (67,6%) 122 (29,3%) 13 (3,1%) |
79 (65,3%) 33 (27,3%) 9 (7,4%) |
Rodzaj operacji -mastektomia -lumpektomia -brak danych |
261 (62,6%) 131 (31,4%) 25 (6%) |
82 (67,8%) 17 (14%) 22 18,2%) |
Do badania włączono 357 pacjentów ze zdiagnozowanym i potwierdzonym histopatologicznie rakiem prostaty. Krew została zebrana w latach 2009-2015 w momencie diagnozy raka prostaty przed rozpoczęciem leczenia. Średni okres obserwacji dla pacjentów wyniósł 5 lat.
| Żyjący (n=293) | Zgony (n=102) |
Gleason 6 7 8 9 10 Brak danych |
85 (29%) 164 (56%) 20 (6,8%) 17 (5,8%) 2 (0,7%) 5 (1,7%) |
39 (38,2%) 35 (34,3%) 9 (8,8%) 11 (10,8%) 7 (6,9%) 2 (1,96%) |
Stopień zaawansowania klinicznego 1-2 3 4 brak danych |
7 (2,7%) 232 (79,2%) 51 (17,4%) 2 (0,7%) |
4 (3,9%) 45 (44,1%) 53 (52%) – |
Radioterpia -tak -nie |
84 (28,7%) 209 (71,3%) |
24 (23,5%) 78 (76,5%) |
Chemioterpia -tak -nie |
3 (1%) 290 (99%) |
4 (3,9%) 98 (96,1%) |
Hormonoterpia -tak -nie |
59 (20,1%) 234 (79,9%) |
40 (39,2%) 62 (60,8%) |
Prostatektomia -tak -nie |
233 (79,5%) 60 (20,5%) |
33 (32,4%) 69 (67,6%) |
Orchidektomia -tak -nie |
8 (2,7%) 285 (97,3%) |
11 (10,8%) 91 89,2%) |
Do grupy włączono 315 pacjentów leczonych operacyjnie w okresie od lipca 2009 do lutego 2017 r. z powodu raka płaskonabłonkowego krtani. Pacjenci stanowili ponad 70% wszystkich pacjentów operowanych w Klinice Otolaryngologii Pomorskiego Uniwersytetu Medycznego w Szczecinie. Od wszystkich chorych zebrano informacje kliniczne dotyczące: wieku zachorowania, płci, stopnia zaawansowania klinicznego, radioterapii, chemioterapii oraz intensywności palenia (paczkolat).
| n=315 | % |
Wiek zachorowania (średnia, zakres) | 61,1 (41-86) |
|
Płeć -kobieta -mężczyzna |
49 266 |
15,6 84,4 |
Stopień zaawansowania klinicznego 1 2 3 4 |
72 42 70 131 |
22,8 13,3 22,2 41,6 |
Paczkolata (średnia, zakres) | 37,11 (0-150) |
|
Leczenie -radioterapia -chemioterpia |
142 32 |
45,1 10,1 |
Grupa badana składała się z 302 pacjentów z rozpoznanym rakiem płuc. Pacjenci pochodzili z Kliniki Chirurgii Klatki Piersiowej w Szczecin – Zdunowo. Pacjenci byli hospitalizowani w okresie od lutego 2010 do Grudnia 2011. Krew została pobrana w momencie diagnozy, przed rozpoczęciem leczenia.
|
| % |
Płeć
Mężczyźni Kobiety |
196 106 |
64,9 35,1 |
Wiek, średnia (zakres) | 64,2 (43-86) | – |
Paczkolata, średnia (zakres) | 33,2 (0-232,8) | – |
Palenie papierosów
Tak Nie |
283 19 |
93,7 6,3 |
Stopień zaawansowania klinicznego 1 2 3 4 |
129 75 79 19 |
42,7 24,8 26,2 6,3 |
Radioterapia
Tak Nie |
78 224 |
25,8 74,2 |
Chemioterapia
Tak Nie |
105 197 |
34,8 65,2 |
Histologia
Gruczolakorak Rak płaskonabłonkowy Rak z dużych komórek Rak mieszany z dużych i małych komórek Rak drobnokomórkowy Inne |
136 124 21 5 3 13 |
45 41,1 7 1,7 1 4,3 |
Do grupy badanej włączono 100 pacjentów z rakiem trzustki.
Charakterystyka grupy została przedstawiona w poniższej tabeli.
| Osoby chore |
Rok urodzenia (zakres) | 1930-1976 |
Wiek w momencie pobrania, średnia (zakres) | 63,4 (35-84) |
Płeć
Mężczyzna Kobieta |
59 41 |
Krewni pierwszego stopnia
Z rakiem trzustki Z rakiem o innej lokalizacji |
4 43 |
Palenie
Tak Nie |
27 73 |
Paczkolata, średnia (zakres) | 28,99 (2-50) |
Do grupy włączono 375 pacjentów ze zdiagnozowanym czerniakiem złośliwym zdiagnozowanych w latach 2006-2016. Krew pacjentów została zabezpieczona w momencie diagnozy, przed rozpoczęciem leczenia.
Charakterystyka grupy badanej została przedstawiona w poniższej tabeli.
| Żyjący (n=344) | Zgony (n=31) |
Wiek (średnia, zakres) | 54,6 (21-90) | 64,3 (38-86) |
Płeć -kobieta -mężczyzna |
218 (63%) 126 (37%) |
14 (45%) 17 (55%) |
Stopień zaawansowania klinicznego 2 3 4-5 |
70 (20%) 145 (42%) 129 (38%) |
1 (3,2%) 12 (39%) 18 (58%) |
Wyniki badań
W organizmie selen działa poprzez białka, do których jest wbudowany w postaci selenocysteiny. Jako składnik selenobiałek selen odgrywa rolę enzymatyczną, jak i strukturalną[1]. Do jednych z ważniejszych funkcji selenobiałek należy udział w produkcji hormonów tarczycy, pobudzanie układu immunologicznego, oraz ochrona przed stresem oksydacyjnym.[2] Zarówno niedobór jak i nadmiar tego pierwiastka może mieć niekorzystny wpływ na organizm. Prowadzi to do m.in. do zaburzeń pracy serca, zwyrodnienia serca i wątroby, zwiększenia ryzyka choroby nadciśnieniowej, ograniczenia sprawności układu odpornościowego, zaburzenia funkcji tarczycy, zaburzenia mineralizacji kości i prawidłowego wykształcenia zębów oraz zwiększenia ryzyka chorób nowotworowych. [3–7]
Ocena ryzyka wystąpienia nowotworów złośliwych u kobiet bez wykrytej mutacji w genie BRCA1
Kobiety powyżej 60 roku życia, niepalące mają istotnie 4,5 krotnie obniżone ryzyko, jeśli mają stężenie we krwi zawierające się w przedziale 94-104 µg/l. Natomiast kobiety powyżej 60 roku życia, które palą obecnie bądź paliły w przeszłości mają istotnie 3,5 krotnie obniżone ryzyko zachorowania na raka, jeśli mają stężenie selenu we krwi > 110 µg/l.
Częstość występowania raków u kobiet niepalących, powyżej 60 roku życia (wybrane zakresy).
Grupa | Zakres [µg/l] | Osoby chore | Osoby zdrowe | OR | 95%CI | p |
I | 94-104 | 3 | 114 | Ref. | Ref. | Ref. |
II | <94 | 11 | 93 | 4,5 | 1,2-16,6 | 0,02* |
*wynik istotny statystycznie (p <0,05) P.438038
Częstość występowania raków u kobiet palących, powyżej 60 roku życia (wybrane zakresy).
Grupa | Zakres [µg/l] | Osoby chore | Osoby zdrowe | OR | 95%CI | p |
I | >110 | 4 | 97 | Ref. | Ref. | Ref. |
II | <110 | 25 | 171 | 3,5 | 1,2-10,5 | 0,02* |
*wynik istotny statystycznie (p <0,05) P.438038
Ocena ryzyka wystąpienia nowotworów złośliwych u kobiet z wykrytą mutacją w genie BRCA1
Kobiety, poniżej 50 roku życia, ze stężeniem selenu we krwi zawierającym się w przedziale 70-80 µg/l, mają tendencję do blisko 5 krotnie obniżonego ryzyka raka w porównaniu do kobiet ze stężeniami selenu poza przedstawionym przedziałem.
Częstość występowania raków w zależności od stężenia selenu we krwi wśród kobiet poniżej 50 roku życia (wybrane zakresy).
Grupa | Zakres [µg/l] | Osoby chore | Osoby zdrowe | OR | 95%CI | p |
I | 70-80 | 1 | 56 | Ref. | Ref. | Ref. |
II | <70 & >80 | 75 | 904 | 4,6 | 0,6-34,1 | 0,1* |
*wynik nieistotny statystycznie (p >0,05) P.435603
Kobiety, powyżej 50 roku życia, ze stężeniem selenu we krwi zawierającym się w przedziale 95-120 µg/l wykazują ponad 2 krotnie obniżone ryzyko zachorowania na raka w porównaniu do kobiet ze stężeniami selenu poza przedstawionym przedziałem.
Częstość występowania raków w zależności od stężenia selenu we krwi wśród kobiet powyżej 50 roku życia (wybrane zakresy).
Grupa | Zakres [µg/l] | Osoby chore | Osoby zdrowe | OR | 95%CI | p |
I | 95-120 | 13 | 156 | Ref. | Ref. | Ref. |
II | <95 & >120 | 20 | 102 | 2,3 | 1,1-4,9 | 0,03* |
*wynik istotny statystycznie (p <0,05) P.435603
Ocena ryzyka wystąpienia nowotworów złośliwych u mężczyzn
Mężczyźni niepalący papierosów, ze stężeniem selenu we krwi zawierającym się w przedziale 100-110 µg/l wykazują blisko 4 krotnie obniżone ryzyko zachorowania na raka w porównaniu do mężczyzn ze stężeniami selenu poza tym przedziałem.
Częstość występowania raków w zależności od stężenia selenu we krwi wśród mężczyzn niepalących (wybrane zakresy).
Grupa | Zakres [µg/l] | Osoby chore | Osoby zdrowe | OR | 95%CI | p |
I | 100-110 | 5 | 260 | Ref. | Ref. | Ref. |
II | <95 | 20 | 291 | 3,6 | 1,3-9,7 | 0,008* |
*wynik istotny statystycznie (p <0,05) P.437898
Natomiast mężczyźni powyżej 60 roku życia oraz palący papierosy w przeszłości bądź obecnie wykazują blisko 11 krotnie zmniejszone ryzyko zachorowania na nowotwór złośliwy, w przypadku występowania stężenia selenu we krwi >115 µg/l, w porównaniu do mężczyzn ze stężeniem selenu we krwi <115 µg/l.
Częstość występowania raków w zależności od stężenia selenu we krwi wśród mężczyzn palących powyżej 60 roku życia (wybrane zakresy).
Grupa | Zakres [µg/l] | Osoby chore | Osoby zdrowe | OR | 95%CI | p |
I | <115 | 1 | 83 | Ref. | Ref. | Ref. |
II | ≥115 | 56 | 427 | 10,9 | 1,5-79,8 | 0,0013* |
*wynik istotny statystycznie (p <0,05) P.437898
Poniżej przedstawiono krzywą Kaplana-Meier’a dla powyższej korelacji.

Probability of cancer-free – prawdopodobieństwo niezachorowania na raka
Months after testing – czas obserwacji w miesiącach
Przeżycia chorych z rakiem piersi
Kobiety z rakiem piersi mają istotnie większą szansę na 10-letnie przeżycie, jeśli ich stężenie selenu w surowicy wynosi >94,7 µg/l. Kobiety ze stężeniem selenu w surowicy < 70 µg/l mają ponad 25-krotnie zwiększone ryzyko zgonu w porównaniu z podgrupą o stężeniu selenu w surowicy 95-102,5 µg/l.
Częstość zgonów w zależności od stężenia selenu w surowicy u kobiet z rakiem piersi w ciągu 10 lat od rozpoznania (ćwiartki).
Ćwiartki | Zakres [µg/l] | Żyjący | Zgony | HR | 95%CI | p |
I | 52,1-76,7 | 89 | 46 | 2,35 | 1,12-4,55 | 0,01* |
II | 76,8-85,1 | 105 | 29 | 1,52 | 0,76-3,02 | 0,23 |
III | 85,2-94,6 | 105 | 29 | 1,95 | 1,01-3,76 | 0,047* |
IV | 94,7-171,5 | 118 | 17 | Ref. | Ref. | Ref. |
*wynik istotny statystycznie (p <0,05)
Częstość zgonów w zależności od stężenia selenu w surowicy u kobiet z rakiem piersi w ciągu 10 lat od rozpoznania (zakresy).
Ćwiartki | Zakres [µg/l] | Żyjący | Zgony | OR | 95%CI | p |
I | < 70 | 32 | 28 | Ref. | Ref. | Ref. |
II | 95-102,5 | 62 | 2 | 27,1 | 6,7-121,2 | <0,0001* |
*wynik istotny statystycznie (p <0,05)
Powyższe wyniki stanowią część publikacji Szwiec M et al., Serum Selenium Level Predicts 10-Years Survival after Breast Cancer; Nutrients 2021, 13(3), 953. [8]
Przeżycia chorych z rakiem prostaty
Mężczyźni z rakiem prostaty oraz stężeniem selenu w surowicy w zakresie 85-105 µg/l wykazują istotnie ponad 8 krotnie zmniejszone ryzyko zgonu w stosunku do podgrupy ze stężeniem selenu w surowicy poniżej 70 µg/l.
Częstość zgonów w zależności od stężenia selenu w surowicy u mężczyzn z rakiem prostaty w ciągu 5 lat od rozpoznania (wybrane zakresy).
Grupa | Zakres [µg/l] | Żyjący | Zgony | OR | 95%CI | p |
I | ≤70 | 61 | 33 | 8,6 | 3,4-21,7 | <0,0001* |
II | 85-105 | 95 | 6 | Ref. | Ref. | Ref. |
*wynik istotny statystycznie (p <0,05) P.437046
Przeżycia chorych z rakiem płuca
Zaobserwowano, że większe szanse na dłuższe przeżycie po diagnozie raka płuca maja osoby, u których stężenie selenu w surowicy wynosi >67,4 µg/l w porównaniu do osób o niskim stężeniu tego pierwiastka w surowicy (<55,1 µg/l).
Częstość zgonów w zależności od stężenia selenu w surowicy u pacjentów z rakiem płuca w I stopniu zaawansowania w ciągu 3 lat od rozpoznania (tertyle).
Tertyle | Zakres [µg/l] | Ilość osób | OR | 95%CI | p |
I | 33,46-57,91 | 43 | 2,73 | 1,21-6,11 | 0,01* |
II | 57,92-68,86 | 42 | 1,88 | 0,83-4,28 | 0,13 |
III | 69,29-108,27 | 44 | Ref. | Ref. | Ref. |
*wynik istotny statystycznie (p <0,05)
Powyższe wyniki stanowią część publikacji Pietrzak S. et al., Influence of the selenium level on overall survival in lung cancer, Journal of Trace Elements in Medicine and Biology 2019, 56:46-51.[9]
Przeżycia chorych z rakiem trzustki
Pacjenci ze zdiagnozowanym rakiem trzustki mają 3-krotnie większą szansę na 6-miesięczne przeżycie, jeśli ich stężenie selenu w surowicy jest ≥ 63,67 µg/l w porównaniu do pacjentów ze stężeniem selenu poniżej tej wartości.
Częstość zgonów w zależności od stężenia selenu w surowicy u pacjentów z rakiem trzustki w ciągu 6 miesięcy od rozpoznania (wybrane zakresy).
Grupa | Zakres [µg/l] | Żyjący | Zgony | OR | 95%CI | p |
I | < 63,67 | 24 | 33 | 0,4 | 0,1-0,97 | 0,03* |
II | ≥ 63,67 | 22 | 11 | Ref. | Ref. | Ref. |
Powyższe wyniki stanowią część publikacji Lener M. et al., Serum concentration of Selenium and Copper in Patients Diagnosed with Pancreatic Cancer, Cancer Res Treat., 2016, 48(3):1056-1064.[10]
Przeżycia chorych z czerniakiem złośliwym
Pacjenci ze zdiagnozowanym czerniakiem złośliwym mają istotnie większą szansę na 10-lecie przeżycie, jeśli ich stężenie selenu w surowicy jest wyższe niż 96 µg/l. Pacjenci ze stężeniem selenu w surowicy < 76 µg/l mają blisko 6-krotnie zwiększone ryzyko zgonu w porównaniu z podgrupą o stężeniu selenu w surowicy > 96 µg/l.
Częstość zgonów w zależności od stężenia selenu w surowicy u pacjentów z czerniakiem złośliwym w ciągu 10 lat od rozpoznania (ćwiartki).
Ćwiartki | Zakres [µg/l] | Żyjący | Zgony | HR | 95%CI | p |
I | 56,7-76,2 | 78 | 16 | 5,83 | 1,32-25,8 | 0,02* |
II | 76,4-85,01 | 86 | 7 | 3,37 | 0,7-16,3 | 0,13 |
III | 85,15-96,06 | 88 | 6 | 3,34 | 0,67-16,7 | 0,14 |
IV | 96,15-168 | 92 | 2 | Ref. | Ref. | Ref. |
*wynik istotny statystycznie (p<0,05) P.438563
Powyższe wyniki stanowią przedmiot publikacji Rogoża-Janiszewska E. et al., Serum selenium level and the 10-year survival after melanoma, Biomedicines, 2021.[11]
Arsen i jego związki są jednymi z najbardziej rozpoznawalnych trucizn. Według klasyfikacji międzynarodowej agencji do badań nad rakiem (IARC, ang. International Agency for Cancer Research) arsen i jego związki zostały określone jako bezwzględne ludzkie karcynogeny – grupa 1.[12] Różnorodność objawów klinicznych wywołanych inhalacją związkami arsenu lub jego spożyciem jest bardzo duża. W zależności od stężenia, czasu ekspozycji i drogi zaabsorbowania skutki oddziaływania arsenu z tkankami są od stosunkowo niegroźnych na przykład hipopigmentacji, po zagrażające życiu nowotwory (WHO). W świetle istniejących danych literaturowych można stwierdzić, że nie tylko wysokie, ale i nieznacznie podwyższone stężenia arsenu mogą być przyczyną raków, zwłaszcza u kobiet.
Ocena ryzyka wystąpienia nowotworów złośliwych u kobiet bez wykrytej mutacji w genie BRCA1
Kobiety ze stężeniem arsenu we krwi poniżej 0,6 µg/l wykazują istotne blisko 5-krotnie obniżone ryzyko rozwoju raków zwłaszcza raków piersi w porównaniu do kobiet ze stężeniem arsenu powyżej 0,6 µg/l (OR=4,7; p=0,0004; 95%CI:1,9-11,7).
Częstość występowania raków piersi w zależności od stężenia arsenu we krwi (wybrane zakresy)
Grupa | Zakres stężeń µg/l | Osoby chore | Osoby zdrowe | OR | 95%CI | p |
I | <0,6 | 5 | 735 | Ref. | Ref. | Ref. |
II | 0,6-0,81 | 18 | 723 | 3,7 | 1,4-10 | 0,01* |
III | 0,82-1,25 | 21 | 719 | 4,3 | 1,6-11-5 | 0,002* |
IV | >1,25 | 32 | 709 | 6,6 | 2,6-17,1 | <0,0001* |
Wybrane zakresy | ||||||
I | <0,6 | 5 | 735 | Ref. | Ref. | Ref. |
II | ≥0,6 | 71 | 2222 | 4,7 | 1,9-11,7 | 0,0004* |
*wynik istotny statystycznie (p <0,05) P.425602
Poniżej przedstawiono krzywą dla powyższej korelacji.

Probability of cancer-free – prawdopodobieństwo niezachorowania na raka
Months after testing – czas obserwacji w miesiącach
Powyższe wyniki stanowią przedmiot publikacji Marciniak W. et al., Blood arsenic levels and the risk of familial breast cancer in Poland, Int J Cancer, 2020, 146 (10): 2721-2727.[13]
Ocena ryzyka wystąpienia nowotworów złośliwych u kobiet z wykrytą mutacją w genie BRCA1
Kobiety ze stężeniem arsenu we krwi poniżej 0,85 µg/l wykazują istotnie około 2-krotnie obniżone ryzyko rozwoju raka w porównaniu do kobiet ze stężeniem arsenu powyżej 0,85 µg/l (OR=2.55; p=0,0006; 95%CI:1,47-4,43).
Częstość występowania nowotworów w zależności od stężenia arsenu we krwi.
Grupa | Zakres stężeń µg/l | Osoby chore | Osoby zdrowe | OR | 95%CI | p |
I | <0,85 | 18 | 513 | Ref. | Ref. | Ref. |
II | >0,85 | 49 | 548 | 2,55 | 1,47-4,43 | 0,0006* |
*wynik istotny statystycznie (p <0,05)
Powyższe wyniki stanowią część publikacji Marciniak W. et al., Blood Arsenic Levels as a Marker of Breast Cancer Risk among BRCA1 Carriers, Cancers 2021, 13(13), 3345. [14]
Ocena ryzyka wystąpienia nowotworów złośliwych u mężczyzn
Wśród mężczyzn, u których stężenie arsenu we krwi wynosi pomiędzy 0,7 a 1,14 µg/l wykazano blisko 5-krotnie obniżone ryzyko zachorowania na raka.
Częstość występowania raków u mężczyzn w zależności od stężenia arsenu we krwi (wybrane zakresy)
Grupa | Zakres [µg/l] | Osoby chore | Osoby zdrowe | OR | 95%CI | p |
I | 0,7-1,14 | 28 | 788 | Ref. | Ref. | Ref. |
II | <0,7 & > 1,14 | 116 | 2003 | 4,8 | 1,1-2,5 | 0,03* |
*wynik istotny statystycznie (p <0,05) P.437896
Przeżycia chorych z rakiem prostaty
Mężczyźni ze stężeniem arsenu w surowicy w zakresie 0,7-1,0 µg/l wykazują istotnie ponad 3-krotnie zmniejszone ryzyko zgonu w stosunku do podgrupy ze stężeniem arsenu w surowicy < 0,7 µg/l.
Częstość zgonów w zależności od stężenia arsenu w surowicy u mężczyzn z rakiem prostaty w ciągu 5 lat od rozpoznania (wybrane zakresy).
Grupa | Zakres [µg/l] | Zgony | Żyjący | OR | 95%CI | p |
I | <0,7 | 22 | 50 | 3,18 | 1,63-6,22 | 0,0009* |
II | 0,7-1,0 | 22 | 159 | Ref. | Ref. | Ref. |
III | >1,0 | 21 | 83 | 1,83 | 0,95-3,52 | 0,085 |
*wynik istotny statystycznie (p <0,05) P.437046
Według IARC kadm i jego związki zostały określone jako bezwzględne ludzkie karcynogeny – grupa 1.[12] Niekorzystne działanie kadmu i jego związków może prowadzić do chorób nerek, sercowo-naczyniowych, nadciśnienia, anemii, uszkodzeń wątroby, zaburzeń funkcjonowania narządów płciowych, zaburzeń układu immunologicznego, niedoborów żelaza, miedzi i cynku, a także rozwinięcia choroby nowotworowej.[15] Liczne prace opisują zwiększone stężenia kadmu w materiale biologicznym osób, które zachorowały na raki prostaty[16,17], nerki[18], pęcherza moczowego[19,20], trzustki[21,22] i piersi[23,24].
W literaturze wymienia się trzy główne źródła kadmu: dieta, palenie tytoniu oraz ekspozycja zawodowa[25]. Stężenie kadmu w produktach spożywczych jest silnie zależne od zawartości tego pierwiastka w środowisku – powietrzu, glebie oraz wodzie[25]. Stężenie kadmu we krwi jest mocno skorelowane z paleniem wyrobów tytotniowych. U osób niepalących stężenie Cd jest niższe w porównaniu do palaczy[26]. Grupę zawodową bardziej narażoną na działanie kadmu stanowią pracownicy przemysłu cynkowego, stalowego i miedziowego oraz przy produkcji baterii niklowo-kadmowych, ogniw słonecznych i biżuterii[27].
Ocena ryzyka wystąpienia nowotworów złośliwych u kobiet bez wykrytej mutacji w genie BRCA1
Poniższa tabela przedstawia rozkład osób badanych w wybranym przez nas zakresie. Ryzyko zachorowania na raka jest ponad 8-krotnie zmniejszone wśród kobiet, których stężenie znajduje się w zakresie 0,28-0,33 µg/l.
Częstość występowania raków w zależności od stężenia kadmu we krwi u kobiet nie palących powyżej 50 roku życia (wybrany zakres)
| Grupa | Zakres [µg/l] | Osoby chore | Osoby zdrowe | OR | 95%CI | p |
| I | 0,28-0,33 | 1 | 126 | Ref. | Ref. | Ref. |
| II | <0,28 & >0,33 | 44 | 665 | 8,34 | 1,1-61,1 | 0,009* |
*wynik istotny statystycznie (p <0,05) P.437608
Ocena ryzyka wystąpienia nowotworów złośliwych u kobiet z wykrytą mutacją w genie BRCA1
U kobiet poniżej 51 roku życia ze stężeniem kadmu we krwi ≤0,32 µg/l ryzyko zmniejszone jest ponad 8-krotnie w porównaniu do kobiet z wyższym poziomem kadmu.
Częstość występowania raków w zależności od stężenia kadmu we krwi u kobiet poniżej 51 roku życia (wybrany zakres)
| Grupa | Zakres [µg/l] | Osoby chore | Osoby zdrowe | OR | 95%CI | p |
| I | ≤0,32 | 1 | 92 | Ref. | Ref. | Ref. |
| II | >0,32 | 22 | 244 | 8,30 | 1,1-62,46 | 0,013* |
*wynik istotny statystycznie (p <0,05) PAT.237085
Powyższe wyniki stanowią przedmiot publikacji przesłanej do druku Derkacz R. et al., Blood Cadmium Level and the Risk of Cancer in Women with BRCA1 Mutations, Cancers, 2021.[28]
Ocena ryzyka wystąpienia nowotworów złośliwych u mężczyzn
Mężczyźni, którzy nigdy nie palili papierosów, u których stężenie kadmu we krwi wynosi < 0,14 µg/l mają blisko 6 krotnie obniżone ryzyko zachorowania na raka w stosunku do mężczyzn ze stężeniem kadmu we krwi > 0,28 µg/l.
Częstość występowania raków w zależności od stężenia kadmu we krwi u mężczyzn niepalących papierosów (ćwiartki)
| Ćwiartka | Zakres [µg/l] | Osoby chore | Osoby zdrowe | OR | 95%CI | p |
| I | 0,03-0,14 | 4 | 260 | Ref. | Ref. | Ref. |
| II | 0,14-0,21 | 7 | 257 | 1,77 | 0,51-6,12 | 0,54 |
| III | 0,21-0,28 | 15 | 249 | 3,92 | 1,28-11,96 | 0,02 |
| IV | 0,28-2,34 | 21 | 242 | 5,64 | 1,91-16,67 | 0,0004* |
*wynik istotny statystycznie (p <0,05)P.437897
Cynk jest pierwiastkiem niezbędnym dla prawidłowego funkcjonowania organizmu. Pełni funkcję ochronną przed wolnymi rodnikami, między innymi wchodząc w skład dysmutazy ponadtlenkowej (SOD2). Zaangażowany jest również w procesy immunologiczne, warunkuje prawidłową funkcję skóry czy też błon śluzowych. Bierze udział w magazynowaniu i wydzielaniu insuliny z trzustki, utrzymuje równowagę jonową innych mikroelementów, w tym selenu, magnezu czy miedzi, a także spełnia rolę detoksykacyjną w stosunku do metali ciężkich[29]. Niedobór tego pierwiastka prowadzi do poważnych zaburzeń takich jak: niedobory immunologiczne, zapalenia (m.in. SARS-Cov-2), nieprawidłowe gojenie ran, obniżenie płodności czy też problemy ze wzrokiem[29,30].
Zaobserwowano, że poziom cynku ulega zmianom w komórkach nowotworowych[31]. Prawidłowe komórki nabłonkowe prostaty akumulują cynk, zaś w komórkach rakowych poziom tego pierwiastka jest znacząco obniżony.[32] Uważa się, że cynk ma działanie przeciwnowotworowe hamując wzrost komórek nowotworowych i aktywując apoptozę. Znane są badania oceniające związek między stężeniem cynku a ryzykiem raków, ich wyniki są jednak rozbieżne. Niektóre z tych badań mówią, iż stężenie cynku w surowicy jest wyższe u osób z nowotworem [33–35], natomiast inne, że poziom ten jest niższy.[36] Wyniki przeprowadzonych do tej pory badań sugerują również, że odpowiednia ilość cynku w diecie działa chemoprewencyjnie. Osoby, których dieta jest bogata w cynk wykazują niższe ryzyko raka płuc niż osoby stosujące dietę ubogocynkową (OR 0,71; 95% CI 0,5-0,99). [37] Również ryzyko raka jelita grubego i odbytu jest niższe przy stosowaniu diety bogatocynkowej (RR 0,86; 95% CI 0,73-1,02).[38] Natomiast suplementacja cynkiem w bardzo wysokich dawkach powyżej 100 mg/dzień (zalecane dzienne spożycie cynku wynosi 8 mg/dzień dla kobiet a 12 mg/dzień dla mężczyzn) odnosi odwrotny efekt, znacząco zwiększając ryzyko wystąpienia raka prostaty (RR 2,29; 95% CI 1,06 – 4,95, p=0,03).[39] Poniżej przedstawiono wyniki badań przeprowadzonych w naszym Ośrodku.
Ocena ryzyka wystąpienia nowotworów złośliwych u kobiet bez wykrytej mutacji w genie BRCA1
Kobiety niepalące, powyżej 50 roku życia ze stężeniem cynku we krwi w przedziale 5600-6100 µg/l mają 6,5 krotnie obniżone ryzyko zachorowania na raka w stosunku do kobiet ze stężeniem cynku poniżej 5600 µg/l, a 3,5 krotnie obniżone ryzyko w porównaniu do kobiet ze stężeniem cynku powyżej 6100 µg/l.
Częstość występowania raków w zależności od stężenia cynku we krwi u kobiet niepalących powyżej 50 roku życia
Grupa | Zakres [µg/l] | Osoby chore | Osoby zdrowe | OR | 95%CI | p |
I | <5600 | 20 | 198 | 6,5 | 1-89-22,12 | 0,0008* |
II | 5600-6100 | 3 | 192 | Ref. | Ref. | Ref. |
III | >6100 | 22 | 399 | 3,5 | 1,04-11,94 | 0,029 |
*wynik istotny statystycznie (p <0,05) P.437571
Ocena ryzyka wystąpienia nowotworów złośliwych u kobiet z wykrytą mutacją w genie BRCA1
Kobiety z mutacją w genie BRCA1, które nie paliły papierosów mają prawie 3 krotnie obniżone ryzyko zachorowania na raka, jeśli ich poziom cynku znajduje się w zakresie 6000-6700 µg/l. Takiej korelacji nie można stwierdzić wśród osób palących papierosy.
Częstość występowania raków w zależności od stężenia cynku we krwi u kobiet będących nosicielkami mutacji w genie BRCA1, które nie paliły papierosów (wybrane zakresy)
Grupa | Zakres [µg/l] | Osoby chore | Osoby zdrowe | OR | 95%CI | p |
I | 6000-6700 | 8 | 218 | Ref. | Ref. | Ref. |
II | <6000&>6700 | 49 | 481 | 2,8 | 1,3-6,0 | 0,006* |
*wynik istotny statystycznie (p <0,05) P.425603
Ocena ryzyka wystąpienia nowotworów złośliwych u mężczyzn
Mężczyźni, którzy nie palili papierosów mają blisko 4 krotnie obniżone ryzyko zachorowania na raka, jeśli ich stężenie cynku we krwi zawiera się w przedziale 5600-6350 µg/l.
Częstość występowania raków w zależności od stężenia cynku we krwi u mężczyzn niepalących (wybrane zakresy)
Ćwiartka | Zakres [µg/l] | Osoby chore | Osoby zdrowe | OR | 95%CI | p |
I | 5600-6350 | 5 | 318 | Ref. | Ref. | Ref. |
II | <5600&>6350 | 41 | 687 | 3,8 | 1,5-9,7 | 0,0018* |
*wynik istotny statystycznie (p <0,05) P.437894
Przeżycia chorych z rakiem piersi
Kobiety ze zdiagnozowanym rakiem piersi oraz stężeniem cynku w surowicy > 1000 µg/l wykazują blisko 6-krotnie zmniejszone ryzyko zgonu w porównaniu do kobiet, u których to stężenie wynosi < 700 µg/l.
Tabela pokazuje częstość zgonów w zależności od stężenia cynku w surowicy u kobiet z rakiem piersi (n=538).
Częstość zgonów w zależności od stężenia cynku w surowicy u kobiet z rakiem piersi w ciągu 10 lat od rozpoznania (wybrane zakresy)
Grupa | Zakres [µg/l] | Żyjący | Zgony | OR | 95%CI | p |
I | ≤700 | 33 | 25 | 5,68 | 2,09-15,42 | 0,0003* |
II | 700-850 | 181 | 54 | 2,24 | 0,91-5,53 | 0,088 |
III | 851-1000 | 158 | 36 | 1,71 | 0,68-4,31 | 0,30 |
IV | ≥1000 | 45 | 6 | Ref. | Ref. | Ref. |
*wynik istotny statystycznie (p <0,05) P.434767
Przeżycia chorych z rakiem prostaty
Mężczyźni ze zdiagnozowanym rakiem prostaty, u których stężenie cynku w surowicy zawiera się w przedziale 1000-1200 µg/l wykazują prawie 4-krotnie zmniejszone ryzyko zgonu w stosunku do mężczyzn, u których stężenie to wynosi < 900 µg/l.
Częstość zgonów w zależności od stężenia cynku w surowicy u mężczyzn z rakiem prostaty w ciągu 5 lat od rozpoznania (ćwiartki)
Grupa | Zakres [µg/l] | Żyjący | Zgony | OR | 95%CI | p |
I | ≤760,38 | 56 | 34 | 8,4 | 3,31-21,33 | <0,0001* |
II | 760,39-839,63 | 75 | 14 | 2,58 | 0,94-7,06 | 0,095 |
III | 839,64-931,72 | 78 | 11 | 1,95 | 0,69-5,53 | 0,31 |
IV | ≥931,73 | 83 | 6 | Ref. | Ref. | Ref. |
*wynik istotny statystycznie (p <0,05) P.437046
Wśród mężczyzn ze zdiagnozowanym rakiem prostaty, u których stężenie cynku w surowicy zawiera się w przedziale 1000-1200 zaobserwowano blisko 4-krotnie zmniejszone ryzyko zgonu, w stosunku do mężczyzn, u których stężenie cynku jest niższe niż 900 µg/l.
Częstość zgonów w zależności od stężenia cynku w surowicy u mężczyzn z rakiem prostaty ciągu 5 lat od rozpoznania (wybrane zakresy)
Grupa | Zakres [µg/l] | Żyjący | Zgony | OR | 95%CI | p |
I | <900 | 180 | 54 | 3,7 | 1,09-12,48 | 0,03* |
II | 1000-1200 | 37 | 3 | Ref. | Ref. | Ref. |
*wynik istotny statystycznie (p <0,05) P.437046
Powyższe wyniki stanowią przedmiot zgłoszenia patentowego nr P.437046
Przeżycia chorych z rakiem krtani
Wśród osób z rakiem krtani ponad 2-krotnie zmniejszone ryzyko zgonu miały osoby chore ze stężeniem cynku powyżej 688 µg/l w surowicy w porównaniu do osób ze stężeniem <580 µg/l.
Częstość zgonów w zależności od stężenia cynku w surowicy u pacjentów z rakiem krtani w ciągu 5 lat od rozpoznania (tercyle)
Grupa | Zakres [µg/l] | Żyjący | Zgony | OR | 95%CI | p |
I | 357,76-580,38 | 52 | 52 | 2,45 | 1,4-4,4 | <0,01* |
II | 584,46-688,89 | 67 | 37 | 1,35 | 0,8-2,4 | 0,31 |
III | 688,94-1317,87 | 76 | 31 | Ref. | Ref. | Ref. |
*wynik istotny statystycznie (p <0,05) P.427370
Powyższe wyniki stanowią przedmiot publikacji Lubiński J. et al., Survival of Laryngeal Cancer Patients Depending on Zinc Serum Level and Oxidative Stress Genotypes, Biomolecules 2021, 11, 865.[40]
Miedź pełni różne funkcje w strukturze białek oraz jako katalizator dzięki zdolności do zmian stopnia utlenienia i redukcji i występuje w stanie utlenionym (Cu2+) lub zredukowanym (Cu+). Jony miedziowe mogą uczestniczyć w szerokim spektrum interakcji z białkami, umożliwiając powstawanie złożonych struktur oraz pośrednicząc w skomplikowanych reakcjach biochemicznych.[41,42] Miedź, podobnie jak inne pierwiastki śladowe, jest z jednej strony niezbędna dla organizmu, z drugiej jednak strony jest bardzo niebezpieczna. Generalnie jednak stany, które charakteryzują się ogólnym lub komórkowo-specyficznym nagromadzeniem miedzi zdarzają się rzadko i najczęściej występują w wyniku określonych zaburzeń o podłożu genetycznym.[43]
Ocena ryzyka wystąpienia nowotworów złośliwych u kobiet bez wykrytej mutacji w genie BRCA1
Kobiety niepalące, w wieku poniżej 50 roku życia ze stężeniem miedzi we krwi pomiędzy 850-1000 µg/l mają niemal 3-krotnie zmniejszone ryzyko zachorowania na raka.
Częstość występowania raków u kobiet niepalących poniżej 50 roku życia, u których nie stwierdzono mutacji w genie BRCA1 (wybrane zakresy).
Grupa | Zakres [µg/l] | Osoby chore | Osoby zdrowe | OR | 95%CI | p |
I | 850-1000 | 16 | 493 | Ref. | Ref. | Ref. |
II | <850 | 13 | 156 | 2,6 | 1,2-5,5 | 0,02* |
*wynik istotny statystycznie (p <0,05) P.438572
Zanieczyszczenie środowiska ołowiem stanowi nieustający problem dla rozwijających się społeczeństw. Toksyczne działanie ołowiu dotyczy głównie jego wpływu na układ krwiotwórczy[44], obwodowy i ośrodkowy układ nerwowy[45] oraz przewód pokarmowy[46]. Ze względu na wszechobecność ołowiu, praktycznie każdy człowiek narażony jest na kontakt z tym pierwiastkiem. Toksyczność ołowiu prowadzi między innymi do zmiany aktywności wielu enzymów oraz zaburzeń funkcji wolnych i strukturalnych białek w komórce[47]. Wiele badań sugeruje, że ważnym molekularnym mechanizmem toksyczności ołowiu jest jego udział w powstawaniu wolnych rodników tlenowych, które odgrywają dużą rolę w powstawaniu uszkodzeń wewnątrzkomórkowych oraz w patogenezie wielu schorzeń, w tym nowotworów złośliwych[48]. Według klasyfikacji karcynogenów IARC, ołów i jego związki należą do grupy 2a i 2b tj. potencjalnie karcinogennych[12].
Ocena ryzyka wystąpienia nowotworów złośliwych u kobiet bez wykrytej mutacji w genie BRCA1
Kobiety, ze stężeniem ołowiu we krwi ≤ 8 µg/l, wykazują istotnie blisko 9-krotnie zmniejszone ryzyko rozwoju raka.
Częstość występowania nowotworów w zależności od stężenia ołowiu u kobiet. (wybrane zakresy).
| Grupa | Zakres [µg/l] | Osoby chore | Osoby zdrowe | OR | 95%CI | p |
| I | ≤8 | 1 | 372 | Ref. | Ref. | Ref. |
| II | >8 | 26 | 1094 | 8,84 | 1,2-65,41 | 0,006* |
*wynik istotny statystycznie (p <0,05) P.433150
Ocena ryzyka wystąpienia nowotworów złośliwych u kobiet z wykrytą mutacją w genie BRCA1
Kobiety, ze stężeniem ołowiu we krwi ≤ 8 µg/l, wykazują istotnie 3-krotnie zmniejszone ryzyko rozwoju raka.
Częstość występowania nowotworów w zależności od stężenia ołowiu u kobiet. (wybrane zakresy).
| Grupa | Zakres [µg/l] | Osoby chore | Osoby zdrowe | OR | 95%CI | p |
| I | ≤8 | 8 | 217 | Ref. | Ref. | Ref. |
| II | >8 | 87 | 812 | 2,9 | 1,4-6,1 | 0,002* |
*wynik istotny statystycznie (p <0,05) P.433150
Ocena ryzyka wystąpienia nowotworów złośliwych u mężczyzn
Mężczyźni poniżej 60 roku życia, niepalący wykazują blisko 8-krotnie obniżone ryzyko zachorowania, jeśli ich stężenie ołowiu jest niższe niż 13,5 µg/l.
Częstość występowania nowotworów w zależności od stężenia ołowiu u mężczyzn niepalących poniżej 60 roku życia (wybrane zakresy).
| Grupa | Zakres [µg/l] | Osoby chore | Osoby zdrowe | OR | 95%CI | p |
| I | <13,5 | 1 | 217 | Ref. | Ref. | Ref. |
| II | >13,5 | 16 | 447 | 7,8 | 1,02-59,0 | 0,017* |
*wynik istotny statystycznie (p <0,05) P.437899
Mężczyźni powyżej 60 roku życia, niepalący wykazują 4-krotnie obniżone ryzyko zachorowania na nowotwory, jeśli ich stężenie ołowiu zawiera się w przedziale 20-50 µg/l we krwi pełnej.
Częstość występowania nowotworów w zależności od stężenia ołowiu u mężczyzn niepalących powyżej 60 roku życia (wybrane zakresy).
| Grupa | Zakres [µg/l] | Osoby chore | Osoby zdrowe | OR | 95%CI | p |
| I | 20-50 | 3 | 74 | Ref. | Ref. | Ref. |
| II | <20 & >50 | 15 | 90 | 4,1 | 1,1-14,8 | 0,02* |
wynik istotny statystycznie (p <0,05) P.437899
Mangan (Mn) jest niezbędnym składnikiem odżywczym biorącym udział w prawidłowym funkcjonowaniu układu odpornościowego, regulacji poziomu cukru we krwi i energii komórkowej, rozmnażania, trawienia, wzrostu kości, krzepnięcia krwi i homeostazy oraz obrony przed reaktywnymi formami tlenu. Funkcje pełnione przez metaloproteiny manganu obejmują oksyreduktazy, transferazy, hydrolazy, liazy, izomerazy oraz ligazy. [49] Mn działa jako kofaktor dla różnych enzymów, w tym arginazy, syntetazy glutaminy (GS), karboksylazy pirogronianowej i dysmutazy ponadtlenkowej Mn (Mn-SOD) [50]. Mn ma tendencję do odkładania się w wątrobie, trzustce, kościach oraz mózgu [50].
W literaturze można znaleźć badania opisujące korelację pomiędzy stężeniem Mn w surowicy a ryzykiem raka piersi oraz jelita grubego. Opublikowane badania mają jednak charakter retrospektywny co powoduje, że nie są one wiarygodne dla stwierdzenia, że mangan jest markerem ryzyka zachorowania na raka. W naszym Ośrodku oceniliśmy korelację pomiędzy stężeniem manganu a przeżyciami kobiet z rakiem piersi.
Przeżycia chorych z rakiem piersi
Kobiety ze zdiagnozowanym rakiem piersi, u których stężenie manganu w surowicy zawiera się w przedziale 1-10 µg/l, wykazują istotnie ponad 1,5 krotnie zmniejszone ryzyko zgonu w odniesieniu do pozostałych kobiet.
Częstość zgonów w zależności od stężenia manganu w surowicy u kobiet z rakiem piersi w ciągu 10 lat od rozpoznania (wybrane zakresy).
Grupa | Zakres µg/l | Żyjący | Zgony | HR | 95%CI | p |
I | 1,0-10,0 | 197 | 49 | Ref. | Ref. | Ref. |
II | <1 & > 10 | 204 | 87 | 1,55 | 1,09-2,20 | 0,01* |
*wynik istotny statystycznie (p <0,05) P.438040
Chrom (Cr) należy do pierwiastków szeroko rozpowszechnionych w skorupie ziemskiej. Pierwiastek ten w niewielkich ilościach jest niezbędny dla prawidłowego funkcjonowania organizmu pełniąc rolę w przemianach metabolicznych glukozy, niektórych białek i tłuszczów [51–53]. Zwiększone dawki chromu mogą mieć silne działanie toksyczne, wpływając destrukcyjnie na wątrobę, nerki i układ krwiotwórczy oraz powodując nowotwory [51,54,55]. Stwierdzono, że Cr(VI) wykazuje silne działanie mutagenne. Wyniki badań asocjacyjnych wskazują na związek pomiędzy stężeniem chromu we krwi oraz ryzykiem nowotworów w obrębie głowy, szyi i jamy ustnej.
W naszym Ośrodku wykonano pracę nad korelacją pomiędzy stężeniem chromu w surowicy a przeżyciem kobiet ze zdiagnozowanym rakiem piersi.
Przeżycia chorych z rakiem piersi
Kobiety ze zdiagnozowanym rakiem piersi, u których stężenie chromu w surowicy zawiera się w przedziale 0,20-3,5 µg/l, wykazują istotnie blisko 2 krotnie zmniejszone ryzyko zgonu.
Częstość zgonów w zależności od stężenia chromu w surowicy u kobiet z rakiem piersi w ciągu 10 lat od rozpoznania (wybrane zakresy).
Grupa | Zakres µg/l | Żyjący | Zgony | HR | 95%CI | p |
I | 0,20-3,5 | 202 | 54 | Ref. | Ref. | Ref. |
II | <0,20 & > 3,5 | 199 | 82 | 1,8 | 1,28-2,54 | 0,0002* |
*wynik istotny statystycznie (p <0,05) P.438042
Kobiety palące papierosy, u których zdiagnozowano nowotwór złośliwy piersi, wykazują istotnie blisko 4,5 krotnie zmniejszone ryzyko zgonu, jeśli ich stężenie chromu w surowicy jest wyższe niż 0,5 µg/l.
Częstość zgonów w zależności od stężenia chromu w surowicy u kobiet palących z rakiem piersi w ciągu 10 lat od rozpoznania (wybrane zakresy).
Grupa | Zakres µg/l | Żyjący | Zgony | HR | 95%CI | p |
I | <0,5 | 157 | 56 | 4,46 | 1,39-14,26 | 0,01* |
II | ≥0,5 | 38 | 3 | Ref. | Ref. | Ref. |
*wynik istotny statystycznie (p <0,05) P.438042
Normy
Pierwiastek | Grupa | Podgrupa | Norma [µg/l] | Publikacja/ Nr zgłoszenia patentowego |
Selen | Kobiety BRCA1 (-) | Palenie (-); < 60 r.ż. Palenie (-); > 60 r.ż. Palenie (+) | 100-110 94-104 110-120 | P.438038 |
| Kobiety BRCA1 (+) | < 50 r.ż. > 50 r.ż. | 70-80 95-120 | P.435603 |
| Mężczyźni | Palenie (-) Palenie (+); < 60 r.ż. Palenie (+); > 60 r.ż. | 100-110 NZ* 115-130 | P.437898 |
Arsen | Kobiety BRCA1 (-) | – | < 0,6 | Marciniak W., 2020[13] P.425602 |
| Kobiety BRCA1 (+) | – | < 0,85 | Marciniak W., 2021[14] |
| Mężczyźni | – | 0,7-1,14 | P.437896 |
Kadm | Kobiety BRCA1 (-) | Palenie (-) < 50 r.ż. Palenie (-) > 50 r.ż. Palenie (+) | NZ* 0,28-0,33 NZ* | P.437608 |
| Kobiety BRCA1 (+) | Palenie (-) Palenie (+) | < 0,27 NZ* | Derkacz R, 2021[28] PAT.237085 |
| Mężczyźni | Palenie (-) Palenie (+) | < 0,21 NZ* | P.437897 |
Cynk | Kobiety BRCA1 (-) | Palenie (-); < 50 r.ż. Palenie (-); > 50 r.ż. Palenie (+) | NZ* 5600-6100 NZ* | P.437571 |
| Kobiety BRCA1 (+) | Palenie (-) Palenie (+) | 6000-6700 6400-6800 | P.425603 |
| Mężczyźni | Palenie (-) Palenie (+) | 5700-6350 NZ* | P.437894 |
Miedź | Kobiety BRCA1 (-) | < 50 r.ż. > 50 r.ż. | 850-1000 < 1000 | P.438572 |
| Kobiety BRCA1 (+) | Palenie (-);< 50 r.ż. Palenie (-); > 50 r.ż. Palenie (+) | 750-825 < 1000 < 1000 | |
| Mężczyźni | – | < 800 | P.437895 |
Ołów | Kobiety BRCA1 (-) | – | ≤ 7,5 | P.438655 |
| Kobiety BRCA1 (+) | – | < 8 | P.433150 |
| Mężczyźni | Palenie (-); < 60 r.ż. Palenie (-); > 60 r.ż. Palenie (+) | < 13,5 < 50 NZ* | P.437899 |
- NZ – dotychczas nie znaleziono korelacji pomiędzy stężeniem pierwiastka a ryzykiem raków w tej podgrupie klinicznej
- Kobiety BRCA1 (-) – kobiety bez wykrytej mutacji w genie BRCA1
- Kobiety BRCA1 (+) – kobiety z wykrytą mutacją w genie BRCA1
- Palenie (-) – osoby niepalące papierosów
- Palenie (+) – osoby palące papierosy
Pierwiastek | Grupa | Norma [µg/l] | Publikacja/ Nr zgłoszenia patentowego |
Selen | Kobiety Mężczyźni | 95-102,5 | Lener M, 2016[10] Lubiński JA, 2018[56] Lubiński J, 20118[57] Pietrzak S, 2019[9] Szwiec M, 2021[8] Rogoża-Janiszewska E., 2021[11] P.437046 |
Arsen | Mężczyźni | 0,75-1,0 | P.437046 |
Cynk | Kobiety Mężczyźni | 1025-1175 | Lubiński J, 2021[40] P.434767 P.437046 |
Miedź | Kobiety Mężczyźni | <1000 ≤ 900 | P.436999 |
Chrom | Kobiety | >0,5 | P.438042 |
Mangan | Kobiety | 1-10 | P.438040 |
- Hariharan, S.; Dharmaraj, S. Selenium and Selenoproteins: It’s Role in Regulation of Inflammation. Inflammopharmacology 2020, 28, 667–695, doi:10.1007/s10787-020-00690-x.
- Combs, G.F.; Clark, L.C.; Turnbull, B.W. An Analysis of Cancer Prevention by Selenium. Biofactors 2001, 14, 153–159, doi:10.1002/biof.5520140120.
- Reddy, V.N.; Giblin, F.J.; Lin, L.R.; Dang, L.; Unakar, N.J.; Musch, D.C.; Boyle, D.L.; Takemoto, L.J.; Ho, Y.S.; Knoernschild, T.; et al. Glutathione Peroxidase-1 Deficiency Leads to Increased Nuclear Light Scattering, Membrane Damage, and Cataract Formation in Gene-Knockout Mice. Invest Ophthalmol Vis Sci 2001, 42, 3247–3255.
- Kuria, A.; Fang, X.; Li, M.; Han, H.; He, J.; Aaseth, J.O.; Cao, Y. Does Dietary Intake of Selenium Protect against Cancer? A Systematic Review and Meta-Analysis of Population-Based Prospective Studies. Crit Rev Food Sci Nutr 2020, 60, 684–694, doi:10.1080/10408398.2018.1548427.
- Jenkins, D.J.A.; Kitts, D.; Giovannucci, E.L.; Sahye-Pudaruth, S.; Paquette, M.; Blanco Mejia, S.; Patel, D.; Kavanagh, M.; Tsirakis, T.; Kendall, C.W.C.; et al. Selenium, Antioxidants, Cardiovascular Disease, and All-Cause Mortality: A Systematic Review and Meta-Analysis of Randomized Controlled Trials. Am J Clin Nutr 2020, 112, 1642–1652, doi:10.1093/ajcn/nqaa245.
- Schomburg, L. The Other View: The Trace Element Selenium as a Micronutrient in Thyroid Disease, Diabetes, and Beyond. Hormones (Athens) 2020, 19, 15–24, doi:10.1007/s42000-019-00150-4.
- Kenfield, S.A.; Van Blarigan, E.L.; DuPre, N.; Stampfer, M.J.; L Giovannucci, E.; Chan, J.M. Selenium Supplementation and Prostate Cancer Mortality. J Natl Cancer Inst 2015, 107, 360, doi:10.1093/jnci/dju360.
- Szwiec, M.; Marciniak, W.; Derkacz, R.; Huzarski, T.; Gronwald, J.; Cybulski, C.; Dębniak, T.; Jakubowska, A.; Lener, M.; Falco, M.; et al. Serum Selenium Level Predicts 10-Year Survival after Breast Cancer. Nutrients 2021, 13, 953, doi:10.3390/nu13030953.
- Pietrzak, S.; Wójcik, J.; Scott, R.J.; Kashyap, A.; Grodzki, T.; Baszuk, P.; Bielewicz, M.; Marciniak, W.; Wójcik, N.; Dębniak, T.; et al. Influence of the Selenium Level on Overall Survival in Lung Cancer. J Trace Elem Med Biol 2019, 56, 46–51, doi:10.1016/j.jtemb.2019.07.010.
- Lener, M.R.; Scott, R.J.; Wiechowska-Kozłowska, A.; Serrano-Fernández, P.; Baszuk, P.; Jaworska-Bieniek, K.; Sukiennicki, G.; Marciniak, W.; Muszyńska, M.; Kładny, J.; et al. Serum Concentrations of Selenium and Copper in Patients Diagnosed with Pancreatic Cancer. Cancer Res Treat 2016, 48, 1056–1064, doi:10.4143/crt.2015.282.
- Rogoża-Janiszewska E. et al Serum Selenium Level and the 10-Year Survival after Melanoma. Biomedicines SI: Role of Trace Elements in Chemoprevention and Cancer Therapy 2021.
- List of Classifications – IARC Monographs on the Identification of Carcinogenic Hazards to Humans Available online: https://monographs.iarc.who.int/list-of-classifications/ (accessed on 20 July 2021).
- Marciniak, W.; Derkacz, R.; Muszyńska, M.; Baszuk, P.; Gronwald, J.; Huzarski, T.; Cybulski, C.; Jakubowska, A.; Falco, M.; Dębniak, T.; et al. Blood Arsenic Levels and the Risk of Familial Breast Cancer in Poland. Int J Cancer 2020, 146, 2721–2727, doi:10.1002/ijc.32595.
- Marciniak, W.; Matoušek, T.; Domchek, S.; Paradiso, A.; Patruno, M.; Irmejs, A.; Roderte, I.; Derkacz, R.; Baszuk, P.; Kuświk, M.; et al. Blood Arsenic Levels as a Marker of Breast Cancer Risk among BRCA1 Carriers. Cancers 2021, 13, 3345, doi:10.3390/cancers13133345.
- Fowler, B.A. Monitoring of Human Populations for Early Markers of Cadmium Toxicity: A Review. Toxicol Appl Pharmacol 2009, 238, 294–300, doi:10.1016/j.taap.2009.05.004.
- Vinceti, M.; Venturelli, M.; Sighinolfi, C.; Trerotoli, P.; Bonvicini, F.; Ferrari, A.; Bianchi, G.; Serio, G.; Bergomi, M.; Vivoli, G. Case-Control Study of Toenail Cadmium and Prostate Cancer Risk in Italy. Sci Total Environ 2007, 373, 77–81, doi:10.1016/j.scitotenv.2006.11.005.
- Qayyum, M.A.; Shah, M.H. Comparative Study of Trace Elements in Blood, Scalp Hair and Nails of Prostate Cancer Patients in Relation to Healthy Donors. Biol Trace Elem Res 2014, 162, 46–57, doi:10.1007/s12011-014-0123-4.
- Pirincci, N.; Gecit, I.; Gunes, M.; Kaba, M.; Tanik, S.; Yuksel, M.B.; Arslan, H.; Demir, H. Levels of Serum Trace Elements in Renal Cell Carcinoma Cases. Asian Pac J Cancer Prev 2013, 14, 499–502, doi:10.7314/apjcp.2013.14.1.499.
- Kellen, E.; Zeegers, M.P.; Hond, E.D.; Buntinx, F. Blood Cadmium May Be Associated with Bladder Carcinogenesis: The Belgian Case-Control Study on Bladder Cancer. Cancer Detect Prev 2007, 31, 77–82, doi:10.1016/j.cdp.2006.12.001.
- Wolf, C.; Strenziok, R.; Kyriakopoulos, A. Elevated Metallothionein-Bound Cadmium Concentrations in Urine from Bladder Carcinoma Patients, Investigated by Size Exclusion Chromatography-Inductively Coupled Plasma Mass Spectrometry. Anal Chim Acta 2009, 631, 218–222, doi:10.1016/j.aca.2008.10.035.
- Farzin, L.; Moassesi, M.E.; Sajadi, F.; Ahmadi Faghih, M.A. Evaluation of Trace Elements in Pancreatic Cancer Patients in Iran. Middle East Journal of Cancer 2013, 4, 79–86.
- Amaral, A.F.S.; Porta, M.; Silverman, D.T.; Milne, R.L.; Kogevinas, M.; Rothman, N.; Cantor, K.P.; Jackson, B.P.; Pumarega, J.A.; López, T.; et al. Pancreatic Cancer Risk and Levels of Trace Elements. Gut 2012, 61, 1583–1588, doi:10.1136/gutjnl-2011-301086.
- Wu, H.-D.I.; Chou, S.-Y.; Chen, D.-R.; Kuo, H.-W. Differentiation of Serum Levels of Trace Elements in Normal and Malignant Breast Patients. Biol Trace Elem Res 2006, 113, 9–18, doi:10.1385/BTER:113:1:19.
- Deeb, M.; El-Sheredy, H.; Mohammed, A. The Role of Serum Trace Elements and Oxidative Stress in Egyptian Breast Cancer Patients. Advances in Breast Cancer Research 2016, 05, 37–47, doi:10.4236/abcr.2016.51004.
- Sabir, S.; Akash, M.S.H.; Fiayyaz, F.; Saleem, U.; Mehmood, M.H.; Rehman, K. Role of Cadmium and Arsenic as Endocrine Disruptors in the Metabolism of Carbohydrates: Inserting the Association into Perspectives. Biomed Pharmacother 2019, 114, 108802, doi:10.1016/j.biopha.2019.108802.
- Lee, J.-E.; Kim, H.-R.; Lee, M.; Kim, N.-H.; Wang, K.-M.; Lee, S.; Park, O.; Hong, E.-J.; Youn, J.-W.; Kim, Y.-Y. Smoking-Related DNA Methylation Is Differentially Associated with Cadmium Concentration in Blood. Biochem Genet 2020, 58, 617–630, doi:10.1007/s10528-020-09965-y.
- Bolam, T.; Bersuder, P.; Burden, R.; Shears, G.; Morris, S.; Warford, L.; Thomas, B.; Nelson, P. Cadmium Levels in Food Containing Crab Brown Meat: A Brief Survey from UK Retailers. Journal of Food Composition and Analysis 2016, 54, 63–69, doi:10.1016/j.jfca.2016.10.005.
- Derkacz R. et al. Blood Cadmium Level and the Risk of Cancer in Women with BRCA1 Mutations. Cancers, SI: Advances in Inherited Breast and Ovarian Cancer and Its Imaging 2021.
- Nasiadek, M.; Stragierowicz, J.; Klimczak, M.; Kilanowicz, A. The Role of Zinc in Selected Female Reproductive System Disorders. Nutrients 2020, 12, 2464, doi:10.3390/nu12082464.
- Puzanowska-Tarasiewicz, H.; Kuźmicka, L.; Tarasiewicz, M. Funkcje biologiczne wybranych pierwiastków i ich związków. 3, 3,. Polski Merkuriusz Lekarski : organ Polskiego Towarzystwa Lekarskiego. 2009, 419–422.
- To, P.K.; Do, M.H.; Cho, J.-H.; Jung, C. Growth Modulatory Role of Zinc in Prostate Cancer and Application to Cancer Therapeutics. Int J Mol Sci 2020, 21, E2991, doi:10.3390/ijms21082991.
- Zaichick VYe, null; Sviridova, T.V.; Zaichick, S.V. Zinc in the Human Prostate Gland: Normal, Hyperplastic and Cancerous. Int Urol Nephrol 1997, 29, 565–574, doi:10.1007/BF02552202.
- Siddiqui, M.K.J.; Jyoti, null; Singh, S.; Mehrotra, P.K.; Singh, K.; Sarangi, R. Comparison of Some Trace Elements Concentration in Blood, Tumor Free Breast and Tumor Tissues of Women with Benign and Malignant Breast Lesions: An Indian Study. Environ Int 2006, 32, 630–637, doi:10.1016/j.envint.2006.02.002.
- Pasha, Q.; Malik, S.A.; Shah, M.H. Statistical Analysis of Trace Metals in the Plasma of Cancer Patients versus Controls. J Hazard Mater 2008, 153, 1215–1221, doi:10.1016/j.jhazmat.2007.09.115.
- el-Ahmady, O.; el-Maraghy, A.; Ibrahim, A.; Ramzy, S. Serum Copper, Zinc, and Iron in Patients with Malignant and Benign Pulmonary Diseases. Nutrition 1995, 11, 498–501.
- Kuo, H.W.; Chen, S.F.; Wu, C.C.; Chen, D.R.; Lee, J.H. Serum and Tissue Trace Elements in Patients with Breast Cancer in Taiwan. Biol Trace Elem Res 2002, 89, 1–11, doi:10.1385/BTER:89:1:1.
- Zhou, W.; Park, S.; Liu, G.; Miller, D.P.; Wang, L.I.; Pothier, L.; Wain, J.C.; Lynch, T.J.; Giovannucci, E.; Christiani, D.C. Dietary Iron, Zinc, and Calcium and the Risk of Lung Cancer. Epidemiology 2005, 16, 772–779, doi:10.1097/01.ede.0000181311.11585.59.
- Zhang, X.; Giovannucci, E.L.; Smith-Warner, S.A.; Wu, K.; Fuchs, C.S.; Pollak, M.; Willett, W.C.; Ma, J. A Prospective Study of Intakes of Zinc and Heme Iron and Colorectal Cancer Risk in Men and Women. Cancer Causes Control 2011, 22, 1627–1637, doi:10.1007/s10552-011-9839-z.
- Leitzmann, M.F.; Stampfer, M.J.; Wu, K.; Colditz, G.A.; Willett, W.C.; Giovannucci, E.L. Zinc Supplement Use and Risk of Prostate Cancer. J Natl Cancer Inst 2003, 95, 1004–1007, doi:10.1093/jnci/95.13.1004.
- Lubiński, J.; Jaworowska, E.; Derkacz, R.; Marciniak, W.; Białkowska, K.; Baszuk, P.; Scott, R.J.; Lubiński, J.A. Survival of Laryngeal Cancer Patients Depending on Zinc Serum Level and Oxidative Stress Genotypes. Biomolecules 2021, 11, 865, doi:10.3390/biom11060865.
- Festa, R.A.; Thiele, D.J. Copper: An Essential Metal in Biology. Curr Biol 2011, 21, R877-883, doi:10.1016/j.cub.2011.09.040.
- Ceramella, J.; Mariconda, A.; Iacopetta, D.; Saturnino, C.; Barbarossa, A.; Caruso, A.; Rosano, C.; Sinicropi, M.S.; Longo, P. From Coins to Cancer Therapy: Gold, Silver and Copper Complexes Targeting Human Topoisomerases. Bioorg Med Chem Lett 2020, 30, 126905, doi:10.1016/j.bmcl.2019.126905.
- Linder, M.C. The Relationship of Copper to DNA Damage and Damage Prevention in Humans. Mutat Res 2012, 733, 83–91, doi:10.1016/j.mrfmmm.2012.03.010.
- Johnson, F.M. The Genetic Effects of Environmental Lead. Mutat Res 1998, 410, 123–140, doi:10.1016/s1383-5742(97)00032-x.
- Marchetti, C. Molecular Targets of Lead in Brain Neurotoxicity. Neurotox Res 2003, 5, 221–236, doi:10.1007/BF03033142.
- Tomczyk, J.; Lewczuk, E.; Abdrzejak, R. Ostre Zatrucia Organicznymi Związkammi Ołowiu.; Medycyna Pracy, 1999; Vol. 50;.
- Cellular Mechanisms of Lead Neurotoxicity – PubMed Available online: https://pubmed.ncbi.nlm.nih.gov/16501435/ (accessed on 20 July 2021).
- Nersesyan, A.; Kundi, M.; Waldherr, M.; Setayesh, T.; Mišík, M.; Wultsch, G.; Filipic, M.; Mazzaron Barcelos, G.R.; Knasmueller, S. Results of Micronucleus Assays with Individuals Who Are Occupationally and Environmentally Exposed to Mercury, Lead and Cadmium. Mutat Res 2016, 770, 119–139, doi:10.1016/j.mrrev.2016.04.002.
- Aschner, M.; Erikson, K. Manganese. Adv Nutr 2017, 8, 520–521, doi:10.3945/an.117.015305.
- Chen, P. Manganese Metabolism in Humans. Front Biosci 2018, 23, 1655–1679, doi:10.2741/4665.
- Bagchi, D.; Stohs, S.J.; Downs, B.W.; Bagchi, M.; Preuss, H.G. Cytotoxicity and Oxidative Mechanisms of Different Forms of Chromium. Toxicology 2002, 180, 5–22, doi:10.1016/s0300-483x(02)00378-5.
- Cefalu, W.T.; Hu, F.B. Role of Chromium in Human Health and in Diabetes. Diabetes Care 2004, 27, 2741–2751, doi:10.2337/diacare.27.11.2741.
- Vincent, J.B. The Biochemistry of Chromium. J Nutr 2000, 130, 715–718, doi:10.1093/jn/130.4.715.
- Anderson, R.A. Chromium Metabolism and Its Role in Disease Processes in Man. Clin Physiol Biochem 1986, 4, 31–41.
- Anderson, R.A. Chromium as an Essential Nutrient for Humans. Regul Toxicol Pharmacol 1997, 26, S35-41, doi:10.1006/rtph.1997.1136.
- Lubinski, J.; Marciniak, W.; Muszynska, M.; Huzarski, T.; Gronwald, J.; Cybulski, C.; Jakubowska, A.; Debniak, T.; Falco, M.; Kladny, J.; et al. Serum Selenium Levels Predict Survival after Breast Cancer. Breast Cancer Res Treat 2018, 167, 591–598, doi:10.1007/s10549-017-4525-9.
- Lubiński, J.; Marciniak, W.; Muszynska, M.; Jaworowska, E.; Sulikowski, M.; Jakubowska, A.; Kaczmarek, K.; Sukiennicki, G.; Falco, M.; Baszuk, P.; et al. Serum Selenium Levels and the Risk of Progression of Laryngeal Cancer. PLoS One 2018, 13, e0184873, doi:10.1371/journal.pone.0184873.
